Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А12 теста ЕГЭ по химии — «Взаимосвязь неорганических веществ»
Если посмотрите это задание в вариантах ЕГЭ, то там дана схема превращений неорганических веществ и в ответах даны варианты реагентов. Как решать такие задачи?
Темы, которые нужно знать:
Составить уравнения реакций по схеме превращений
На самом деле это не так и сложно. Для этого необходимо знать типы реакций и основные условия их протекания.
1. Химические реакции соединения
- Реакция горения — одна из самых распространенных химических реакций соединения — все вещества горят — и металлы, и неметаллы:
- Химические реакции соединения металла и неметалла — приводят к образованию солей:
(а вот этот момент надо запомнить (или выучить) — железо при взаимодействии с соляной кислотой дает хлорид железа (II), а с хлором — простым веществом — хлорид железа (III))
- Неметаллы также могут взаимодействовать между собой:
2. Составление уравнений реакций по схеме — реакции разложения
- Обычно уравнения реакций разложения солей дают соответствующие основные и кислотные оксиды:
Исключения:
- по-другому разлагаются нитраты — в зависимости от металла, входящего в состав соли. Это можно прочитать >;
- хлорид аммония — NH4Cl — разлагается до аммиака и соляной кислоты: NH4Cl = NH3 + HCl;
- не разлагаются сульфаты
- соли, образованные сильными окислителями:
- Разлагаются некоторые основания:
3. Составление уравнений реакций по схеме — п римеры реакций замещения
- реакция замещения водорода в кислотах:
когда нам дана реакция замещения металлом водорода в кислотах, нужно учитывать электрохимический ряд напряжений металлов: металлы, находящиеся в ряду ДО водорода, вытесняют его из кислот:
2Na + 2HCl = 2NaCl + H2
- реакции замещения в солях:
Ca + 2NaCl = CaCl2 +2 Na
Правило: предыдущий металл вытесняет последующий из его солей
(т.е. реакция Na + CaCl2 не будет идти)
4. Составление уравнений реакций по схеме — р еакции обмена веществ
Здесь следующие правила — обменные реакции идут в сторону образования продуктов при:
- выпадении осадка: NaCl + AgNO3 = AgCl↓ + NaNO3
- выделении газа: Na2CO3 + HCl = NaCl + CO2 + H2O ;
- образовании малодиссоциирующего вещества (H2O, NH4OH, органические кислоты и соли и т.д.): NaOH + H2SO3 = Na2SO3 + H2O
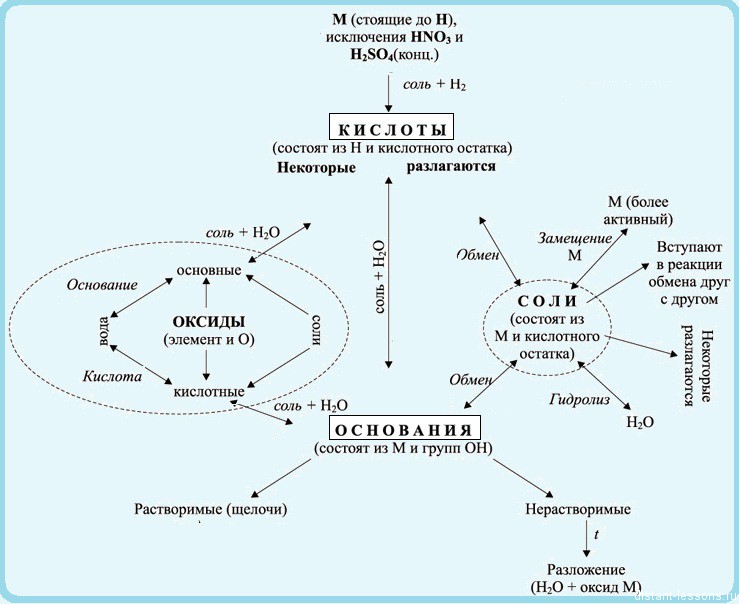
Взаимосвязь неорганических веществ можно отобразить такой таблицей:
Теория, это, конечно, хорошо, но давайте попрактикуемся — попробуем составить уравнения реакций по схемам превращений
В первой реакции к меди можно прибавить либо AgNO3, либо HNO3 — в ряду напряжений медь стоит до серебра, а азотная кислота будет давать окислительно-восстановительную реакцию.
Во второй части схемы нам подходит K2S или H2S, т.к. сульфид меди — осадок.
Ответ: 1)
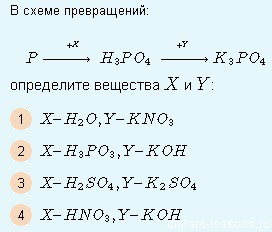
Составим уравнения реакций для данной схемы превращений:
Первая реакция — переход фосфора в фосфорную кислоту — такое под силу только мощным окислителям — либо серной, либо азотной кислоте.
Вторая реакция — обменная — K2SO4 даст растворимые продукты, а вот KOH — в самый раз! Получится вода — малодиссоциирующее вещество.
Типы химических реакций. Схемы превращений
Типы химических реакций. Схемы превращений
А1. Что относится к химическим явлениям?
1) испарение воды 2) горение дров 3) перегонка нефти 4) плавление олова
А2. Чем характеризуется экзотермическая реакция?
1) она сопровождается поглощением тепла
2) теплового эффекта не наблюдается
3) она сопровождается выделением тепла
4) таких реакций нет
А3. Как называется реакция, в результате которой из одного сложного вещества образуется несколько новых веществ?
1) реакция соединения 3) реакция обмена
2) реакция замещения 4) реакция разложения
А4. Чему равна сумма коэффициентов в уравнении реакции Са(ОН)2 + HNО3 → Ca(NО3)2 + Н2О?
1) 4 2)6 3) 5 4) 12
А5. Какая масса воды образуется при взаимодействии 0,5 моль водорода с кислородом? 1) 4,5 г 2) 9 г 3) 18 г 4) 1,8 г
А6. Какое вещество обозначено символом х в схеме превращений Li → x →LiOH?
1) Li2O 2) LiO 3) LiNО3 4) LiCl
В1. Установите соответствие.
Тип химической реакции
Схема химической реакции
А. Реакция разложения
Б. Реакция обмена
В. Реакция замещения
Г. Реакция соединения
1) MgCO3 → CO2↑ + MgO
2) CuO + Аl → Сu + Аl2O3
4) ZnO + H2 → Zn + H2O
5) НС1 + NaOH → NaCl + H20
6) BaCl2 + Na2S04 → BaS04↓ + NaCl
В2. Восстановите правую часть уравнения реакции по его левой части.
Левая часть уравнения
Правая часть уравнения
С1. Составьте уравнение реакции по описанию, дайте характеристику уравнения реакции: сульфат железа(III) + гидроксид калия = гидроксид железа(III) + сульфат калия.
С2. Составьте уравнения реакций по схеме превращений: S → SO2 → SO3 → H2SO4 → Na2SO4.
Типы химических реакций. Схемы превращений
А1. Что относится к химическим явлениям?
1) испарение воды 3) перегонка нефти
2) замерзание воды 4) скисание молока
А2. Чем характеризуется эндотермическая реакция?
1) она сопровождается поглощением тепла
2) теплового эффекта не наблюдается
3) она сопровождается выделением тепла
4) таких реакций нет
А3. Как называется реакция, в результате которой из не скольких веществ образуется новое сложное вещество?
1) реакция соединения 3) реакция обмена
2) реакция замещения 4) реакция разложения
А4. Чему равна сумма коэффициентов в уравнении реакции Na2CO3 + HNO3 → NaNO3 + Н2O + СO2? 1) 8 2)6 3) 7 4) 5
А5. Какая масса оксида кальция образуется при взаимодействии 0,5 моль кальция с кислородом? 1) 56 г 2) 28 г 3) 5,6 г 4) 2,8 г
А6. Какое вещество обозначено символом х в схеме пре вращений S → x → SO3?
1) SO 2) SO2 3) H2S 4) Na2S
В1. Установите соответствие.
Тип химической реакции
Схема химической реакции
А. Реакция разложения
Б. Реакция обмена
В. Реакция замещения
Г. Реакция соединения
1) MgCO3 + НС1 → CO2↑+ H2O + + MgCl2
2) FeO + А1 → Fe + А12O3
3) N2O5 + Н2O → HNO3
4) SnO + С → Sn + CO2↑
5) H2SO4 + NaOH → Na2SO4 + H2O
6) NaHCO3 → Na2CO3 + H2O + CO2↑
В2. Восстановите правую часть уравнения реакции по его левой части.
Левая часть уравнения
Правая часть уравнения
С1. Составьте уравнение реакции по описанию, дайте характеристику уравнения реакции: фосфат калия + гидроксид кальция = фосфат кальция + гидроксид калия.
С2. Составьте уравнения реакций по схеме превращений: С → СО → СO2 → Н2СO3 → К2СO3.
А1; Б — 5, 6; В-2,4; Г3
А6; Б — 1, 5; В-2,4; Г3
C1. Fe2(SO4)3 + 6КОН = 2Fe(OH)3↓ + 3К2SO4.
Исходные продукты реакции, состав, класс вещества, количество вещества: Fe2(SO4)3 — сульфат желе — за(III), сложное вещество, средняя соль, растворимая, 1 моль; КОН — гидроксид калия, сложное вещество, растворимое основание (щелочь), 6 моль.
Конечные продукты реакции, состав, класс вещества, количество вещества: Fe(OH)3 — гидроксид железами), сложное вещество, нерастворимое основание, 2 моль; K2SO4- сульфат калия, сложное вещество, средняя соль, растворимая, 3 моль.
Тип: реакция обмена.
Признак реакции: выпадает осадок, гидроксид железа(III) — Fe(OH)3.
С2. S + O2 → SO2 — оксид cepы (IV); 2SO2 + O2 → 2SO3 — оксид серы (VI); SO3 + Н2O → H2SO4 — серная кислота;
H2SO4 + 2NaOH → Na2SO4 + 2H2O — сульфат натрия и вода.
C1. 2К3 РO4 + 3Са(ОН)2 = Ca3(PO4)2↓ + 6КОН.
Исходные продукты реакции, состав, класс вещества, количество вещества: К3РO4 — фосфат калия, сложное вещество, средняя соль, 2 моль; Са(ОН)2 — гидроксид кальция, сложное вещество, малорастворимое основание, раствор — известковая вода (щелочь), 3 моль.
Конечные продукты реакции, состав, класс вещества, количество вещества: Са3(РO4)2 — фосфат кальция, сложное вещество, средняя соль, нерастворимая, моль; КОН — гидроксид калия, сложное вещество, растворимое основание (щелочь), 6 моль.
Тип: реакция обмена.
Признак реакции: выпадает осадок, фосфат кальция — Са3(РO4)2.
С2. 2С + 02 → 2СО — оксид углерода(II); 2СО + O2 → 2СO2 — оксид углерода(IV); СO2 + Н2O → Н2СO3 — угольная кислота; Н2СO3 + 2КОН → К2СO3 + 2 Н2O — карбонат калия и вода.
Составить уравнения химических превращений по схеме
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Можно ли записать реакцию в виде Сu(NO3)2=CuO+N2O5
Нет, потому что разложение нитрата меди выглядит так
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для третьего превращения:
4)
http://pandia.ru/text/82/390/39834.php
http://chem-oge.sdamgia.ru/test?theme=25