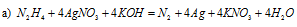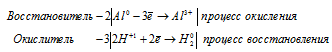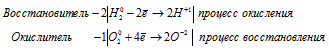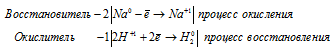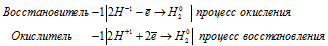Характеристика окислительно-восстановительных свойств пероксида водорода и гидразина
Задача 622.
Указать, в каких из следующих реакций пероксид водорода служит окислителем, а в каких — восстановителем: 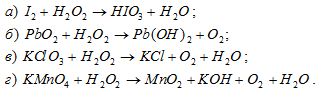
Решение: 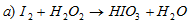
В данной реакции йод повышает свою степень окисления от 0 до +5, а кислород перекиси водорода понижает свою степень окисления от -1 до -2, т.е. перекись водорода — окислитель. 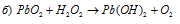
В данной реакции свинец понижает свою степень окисления от +4 до +2, а кислород перекиси водорода повышает от -1 до 0, т.е. пероксид водорода – восстановитель. 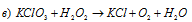
В данной реакции хлор понижает свою степень окисления от +7 до -1, а кислород перекиси водорода повышает от -1 до 0, т.е. пероксид водорода – восстановитель. 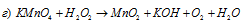
В данной реакции марганец понижает свою степень окисления от +7 до +4, а кислород перекиси водорода повышает от -1 до 0, т. е. пероксид водорода – восстановитель.
Задача 623.
Указать, в какой из приведенных реакций гидразин N2H4 служит окислителем, и в какой — восстановителем: 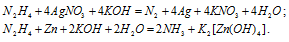
Как изменяется в каждом случае степень окисленности азота?
Решение:
В данной реакции серебро понижает свою степень окисления от +1 до 0, а азот гидразина повышает от -2 до 0, т. е. гидразин – восстановитель. 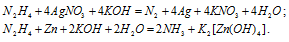
В данной реакции цинк повышает свою степень окисления от 0 до +2, а атом азота гидразина понижает свою степень окисления от -2 до -3, т. е. гидразин — окислитель.
Задача 624.
Составить уравнения полуреакций окисления и восстановления для следующих реакций и определить, в каких случаях водород служит окислителем и в каких восстановителем:
а) 2Al + 6HCl⇔ 2AlCl3 + 3H2↑;
б) 2H2 + O2 ⇔ 2H2O;
в) 2Na + 2H2O ⇔ 2NaOH + H2↑;
г) BaH2 + 2H2O ⇔ Ba(OH)2 + 2H2↑.
Решение:
а) 2Al + 6HCl ⇔2AlCl3 + 3H2↑
Водород восстанавливается, понижая свою степень окисления от +1 до 0, т. е. является окислителем.
Водород окисляется, повышая свою степень окисления от 0 до +1, т. е. является восстановителем.
в) 2Na + 2H2O ⇔ 2NaOH + H2↑
Водород восстанавливается, понижая свою степень окисления от +1 до 0, т. е. является окислителем.
г) BaH 2 + 2H 2 O ⇔ Ba(OH) 2 + 2H 2 ↑.
Водород гидрида бария окисляется, повышая степень окисления от -1 до 0, а водород во-ды – восстанавливается, понижая степень окисления от +1 до 0. Таким образом, водород в ВаН2 является восстановителем, а в Н2О – окислителем.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df106aa087b978b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составьте уравнения полуреакций окисления и восстановления, назовите атом-окислитель и атом-восстановитель. Используя метод
Ваш ответ
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://gomolog.ru/reshebniki/9-klass/eremin-2019/16/4.html
http://www.soloby.ru/896592/%D1%81%D0%BE%D1%81%D1%82%D0%B0%D0%B2%D1%8C%D1%82%D0%B5-%D0%BF%D0%BE%D0%BB%D1%83%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B9-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C