Электролиз солей
Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
Электролизер
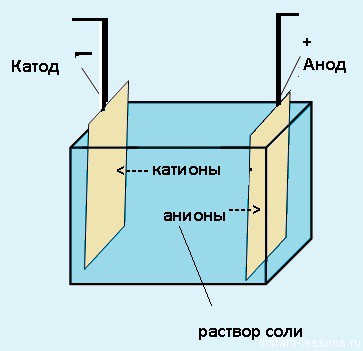
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав или водный раствор соли. Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
Электролиз расплава NaCl
При электролизе расплава NaCl на отрицательном электроде (катоде) происходит присоединение электронов ионом натрия Na + и его восстановление. При этом вблизи электрода концентрация ионов Na + уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na + .
Аналогично происходит миграция ионов Cl — к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2Na + + 2e — → 2Na 0 |
| 2Na + + 2Cl — → 2Na 0 + Cl2 0 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
Сложнее протекает электролиз водных растворов электролитов.
Электролиз водного раствора NaCl
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2H 2 O + 2e — → H2 0 +2OH — |
| 2H2O + 2Cl — → H2 0 + Cl2 0 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu 2+ , Hg2 2+ , Ag + , Hg 2+ , Pt 2+ до Pt 4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li + , Na + … до Al 3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn 2+ , Zn 2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu 2+ , Ag + , Zn 2+ сначала восстановится Ag + (E = +0,79 В), затем Cu 2+ (E = +0,337 В) и только потом Zn 2+ (E = +0,76 В).
Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
- При электролизебескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl — -2e — = Cl2
- При электролизекислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e — = O2 + 4H +
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO3 2- + H2O -2e — = SO4 2- + 2H +
В таблице ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом | CuBr2 + H2O = Cu + Br2 + H2O K: Cu 2+ + 2e — = Cu |
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом | K2SO4 + 2H2O = K2SO4 + 2H2 + O2 Т.е. происходит разложение воды |
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом | KI + H2O = 2KOH + H2 + I2 |
| Водный раствор соли малоактивного металла с анодом из того же металла | CuSO4 K: Cu 2+ + 2e — = Cu A: Cu — 2e — = Cu 2+ Электролиз солей — количественные аспектыСвязь между количеством вещества, выделившегося при электролизе соли и количеством прошедшего через него электричества отражена в законах Фарадея. 1 закон Фарадея
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества. 2 закон Фарадея
Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея. m – масса вещества, Э – электрохимический эквивалент, t – время электролиза. Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом. Задачи с решениями на составление уравнений электродных реакций, протекающих при электролизе, а также на применение законов Фарадея приведены в разделе Задачи к разделу Электролиз солей Химия, Биология, подготовка к ГИА и ЕГЭЭлектролиз водных растворов солейТема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей. Электролиз водных растворов солей Для начала давайте представим себе систему, в которой происходит электролиз.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции. При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
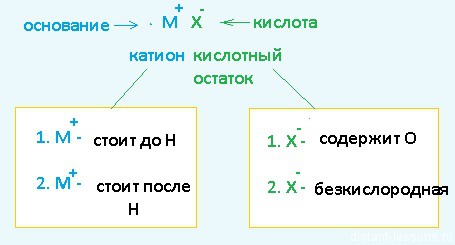
Теперь рассмотрим электролиз водных растворов различных солей Разберем сначала катионы :
Теперь анионы-кислотные остатки :
Примеры: 1 .1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О: 1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный: анод (+): Cl − — 1e = Cl 0 ; Cl 0 +Cl 0 =Cl2 2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О: K(-): Cu 2+ + 2e = Cu 0 2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный: катод (-): Cu 2+ + 2e = Cu 0 анод (+): 2Cl − — 2e = 2Cl 0 Электролиз водных растворов солей отличается от электролиза расплавов.
Обсуждение: «Электролиз водных растворов солей»Здравствуйте. Очень благодарна вам за такое понятное объяснение темы. Водород — правильный ответ. В ответах к тренировочным тестам ЕГЭ очень часто бывают ошибки. Да и не только в ответах. В этом году, например, в заданиях пробных ЕГЭ быди ошибки! 1. Запишите все возможные процессы на аноде, установите потенциалы процессов. 2. Сравните потенциалы анодных процессов и определите, какой из них протекает в первую очередь? 3. Выясните, меняется ли среда около анода, если да, то как и почему? 4. Запишите все возможные процессы на катоде, установите потенциалы процессов. 5. Сравните потенциалы катодных процессов и определите, какой из них протекает в первую очередь. 6. Установите, меняется ли среда около катода, если да, то как и почему? 7. Запишите итоговую схему процесса электролиза. 0,1 M раствор CuSO4 pH = 5, катод – Al, анод – Сu здесь решают задачи школьного уровня. Не сможем вам помочь Алгоритм составления уравнений электролиза растворов солейОбращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах. Алгоритм составления уравнений электролиза растворов 1. Записать уравнение электролитической диссоциации 2. Определить катодный процесс. Для этого воспользоваться схемой:
Для этого воспользоваться схемой:
4. Составить уравнение электролиза: 4.1. В левой части записать формулы электролита и воды 4.2. В правой части записать формулы веществ, образовавшихся на катоде и аноде, а также составить молекулярную формулу из ионов, оставшихся на катоде и аноде. 4.3. Если в правой и левой частях есть одинаковые формулы, вычеркнуть их. 4.4. Расставить коэффициенты. Курс повышения квалификации Дистанционное обучение как современный формат преподавания
Курс повышения квалификации Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
Курс повышения квалификации Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Ищем педагогов в команду «Инфоурок» Дистанционные курсы для педагогов«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни» Свидетельство и скидка на обучение каждому участнику Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:5 582 968 материалов в базе Самые массовые международные дистанционные Школьные Инфоконкурсы 2022 33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок» Другие материалы
Вам будут интересны эти курсы:Оставьте свой комментарийАвторизуйтесь, чтобы задавать вопросы. Добавить в избранное
Настоящий материал опубликован пользователем Буторина Юлия Михайловна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал. Автор материала
Московский институт профессиональной Дистанционные курсы |



 3. Определить анодный процесс.
3. Определить анодный процесс. Внимание! Ион F — рассматривать как кислородсодержащий ион!
Внимание! Ион F — рассматривать как кислородсодержащий ион!

