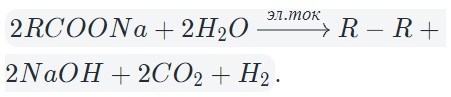Электролиз солей
Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
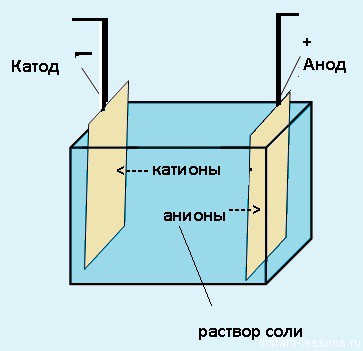
Электролизер
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав или водный раствор соли. Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
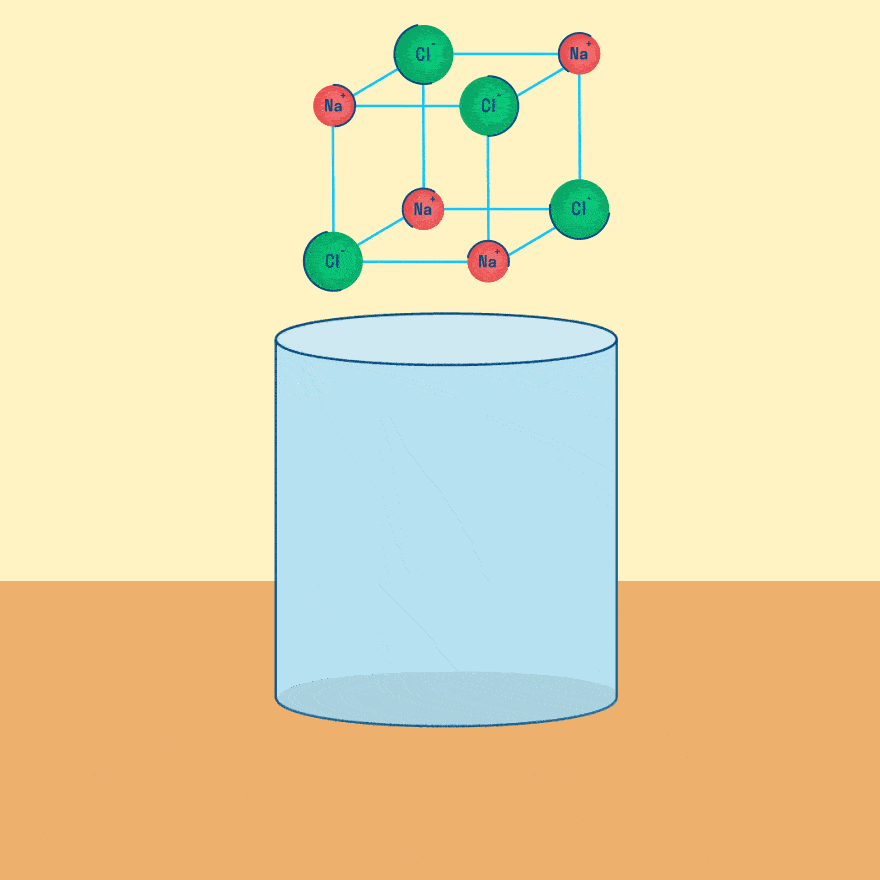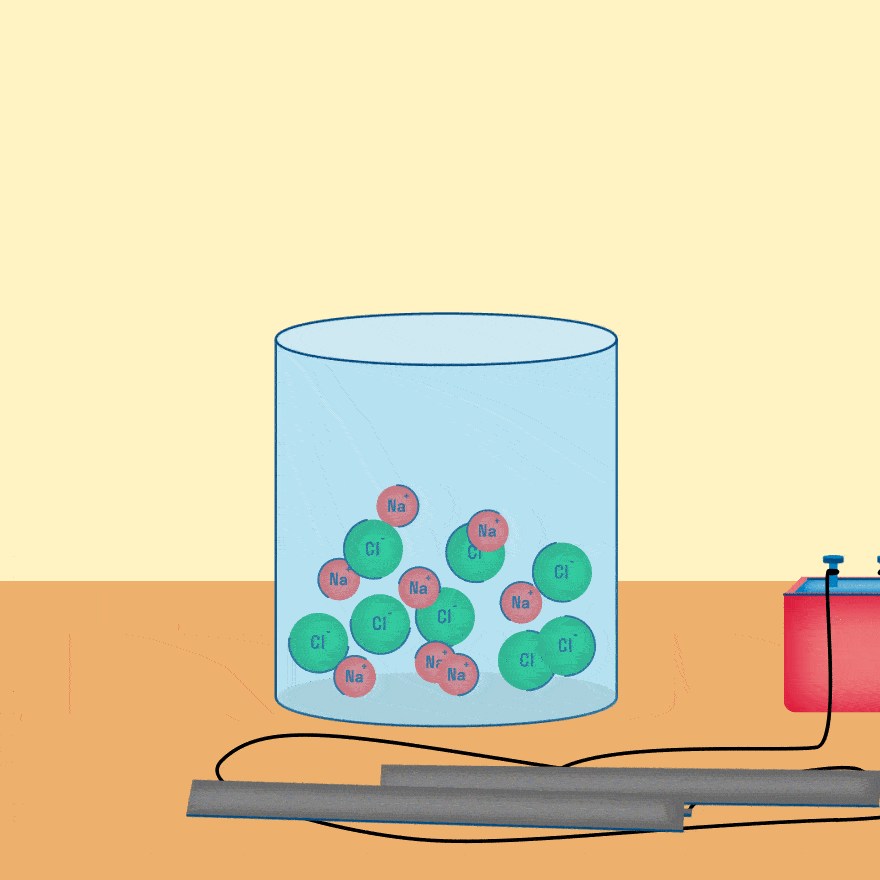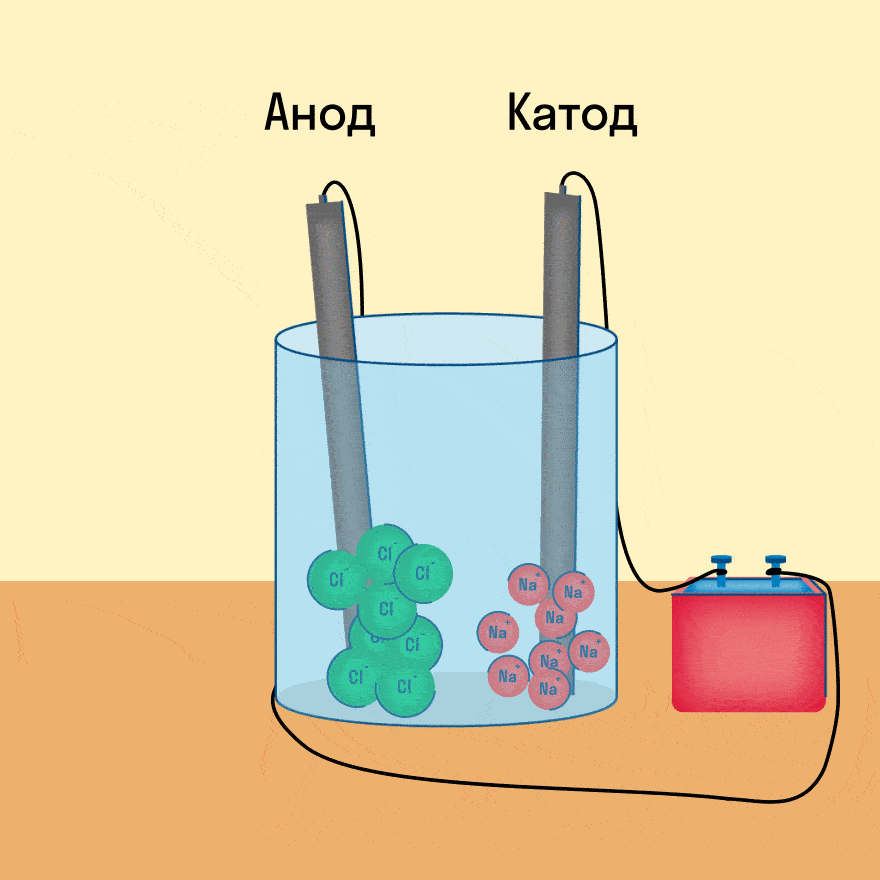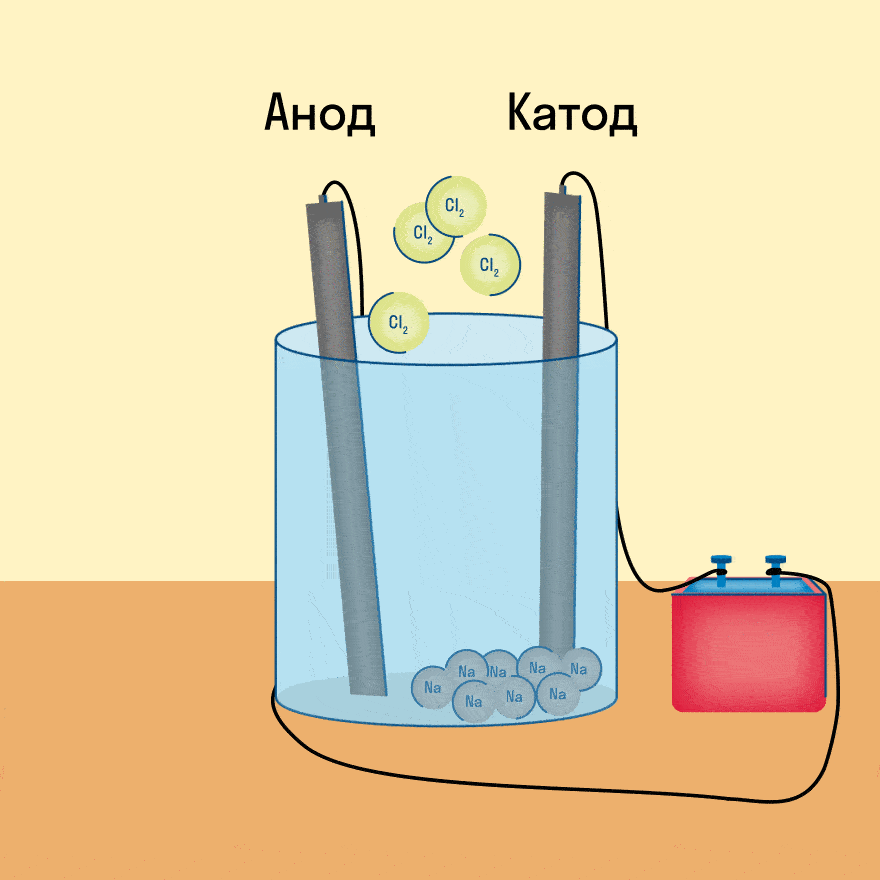
Электролиз расплава NaCl
При электролизе расплава NaCl на отрицательном электроде (катоде) происходит присоединение электронов ионом натрия Na + и его восстановление. При этом вблизи электрода концентрация ионов Na + уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na + .
Аналогично происходит миграция ионов Cl — к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2Na + + 2e — → 2Na 0 |
| 2Na + + 2Cl — → 2Na 0 + Cl2 0 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
Сложнее протекает электролиз водных растворов электролитов.
Электролиз водного раствора NaCl
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2H 2 O + 2e — → H2 0 +2OH — |
| 2H2O + 2Cl — → H2 0 + Cl2 0 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu 2+ , Hg2 2+ , Ag + , Hg 2+ , Pt 2+ до Pt 4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li + , Na + … до Al 3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn 2+ , Zn 2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu 2+ , Ag + , Zn 2+ сначала восстановится Ag + (E = +0,79 В), затем Cu 2+ (E = +0,337 В) и только потом Zn 2+ (E = +0,76 В).
Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
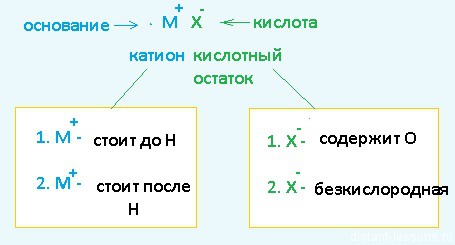
- При электролизебескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl — -2e — = Cl2
- При электролизекислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e — = O2 + 4H +
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO3 2- + H2O -2e — = SO4 2- + 2H +
В таблице ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом | CuBr2 + H2O = Cu + Br2 + H2O K: Cu 2+ + 2e — = Cu |
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом | K2SO4 + 2H2O = K2SO4 + 2H2 + O2 Т.е. происходит разложение воды |
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом | KI + H2O = 2KOH + H2 + I2 |
| Водный раствор соли малоактивного металла с анодом из того же металла | CuSO4 K: Cu 2+ + 2e — = Cu A: Cu — 2e — = Cu 2+ Электролиз солей — количественные аспектыСвязь между количеством вещества, выделившегося при электролизе соли и количеством прошедшего через него электричества отражена в законах Фарадея. 1 закон Фарадея
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества. 2 закон Фарадея
Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея. m – масса вещества, Э – электрохимический эквивалент, t – время электролиза. Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом. Задачи с решениями на составление уравнений электродных реакций, протекающих при электролизе, а также на применение законов Фарадея приведены в разделе Задачи к разделу Электролиз солей Химия, Биология, подготовка к ГИА и ЕГЭЭлектролиз водных растворов солейТема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей. Электролиз водных растворов солей Для начала давайте представим себе систему, в которой происходит электролиз.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
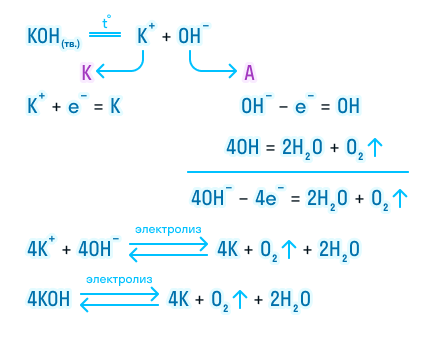
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции. При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
Теперь рассмотрим электролиз водных растворов различных солей Разберем сначала катионы :
Теперь анионы-кислотные остатки :
Примеры: 1 .1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О: 1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный: анод (+): Cl − — 1e = Cl 0 ; Cl 0 +Cl 0 =Cl2 2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О: K(-): Cu 2+ + 2e = Cu 0 2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный: катод (-): Cu 2+ + 2e = Cu 0 анод (+): 2Cl − — 2e = 2Cl 0 Электролиз водных растворов солей отличается от электролиза расплавов.
Обсуждение: «Электролиз водных растворов солей»Здравствуйте. Очень благодарна вам за такое понятное объяснение темы. Водород — правильный ответ. В ответах к тренировочным тестам ЕГЭ очень часто бывают ошибки. Да и не только в ответах. В этом году, например, в заданиях пробных ЕГЭ быди ошибки! 1. Запишите все возможные процессы на аноде, установите потенциалы процессов. 2. Сравните потенциалы анодных процессов и определите, какой из них протекает в первую очередь? 3. Выясните, меняется ли среда около анода, если да, то как и почему? 4. Запишите все возможные процессы на катоде, установите потенциалы процессов. 5. Сравните потенциалы катодных процессов и определите, какой из них протекает в первую очередь. 6. Установите, меняется ли среда около катода, если да, то как и почему? 7. Запишите итоговую схему процесса электролиза. 0,1 M раствор CuSO4 pH = 5, катод – Al, анод – Сu здесь решают задачи школьного уровня. Не сможем вам помочь Электролиз расплавов и растворовО чем эта статья: 11 класс, ЕГЭ/ОГЭ Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав. Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним. Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления. Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины. Виды электролизаРазличают два вида электролиза: Электролиз водного раствора. Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах. Процесс на катоде K (−) Катион принимает электроны и восстанавливается: Me +n + ne − → Me 0 (восстановление). Процесс на аноде A (+) Анион отдает электроны и окисляется: неMe −n − ne − → неMe 0 (окисление). Процессы, протекающие при электролизе в общем случае: К − : Ме +n + ne − → Ме 0 ; А + : неМе −n − ne − → неМе 0 . Суммарное уравнение электролиза: Электролиз расплаваРассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток. К − : 2Na + + 2e − = 2Na 0 А + : 2Cl − − 2e − = Cl2 Суммарное уравнение электролиза: При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны. Теперь давайте рассмотрим электролиз расплава гидроксида калия. На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде. Электролиз раствораОсновным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH — как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF: К − : 4H2O + 4e − = 2H2 0 + 4OH − Суммарное уравнение электролиза: Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит? Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода. Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности. Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения. Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла. Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе. Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды. Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла. При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода. Для удобства мы собрали информацию об электролизе в таблице: Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде: Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона. Если анод инертный или нерастворимый, то на нем протекают следующие реакции: При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона. При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе. При электролизе растворов щелочей происходит окисление гидроксид-ионов. Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона. Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит. В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов. В общем виде электролиз солей карбоновых кислот можно записать так: На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь. В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната. Применение электролизаА теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР: С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие. В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ. Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид. Вопросы для самопроверки1. Выберите верное продолжение фразы «катод — это. »: Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы. Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы. Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы. Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы. 2. Продолжите фразу «электролиз — это…»: ОВР с применением тока. Реакция без изменения степеней окисления с применением тока. ОВР с применением катализаторов. 3. Как заряжен анион? Не имеет заряда. 4. Чем отличается электролиз раствора от электролиза расплава? В расплаве плавится твердое. Присутствием молекул воды и продуктов ее диссоциации. 5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде? Металл и водород. При электролиза водного раствора фторида лития что на аноде выделится? источники: http://distant-lessons.ru/ximiya/elektroliz http://skysmart.ru/articles/chemistry/elektroliz-rasplavov-i-rastvorov |