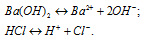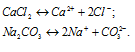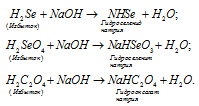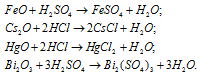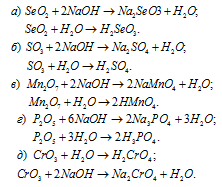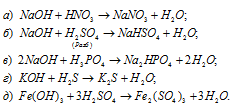Решение задач по теме «Классы неорганических соединений»
Задача 149.
Можно ли получить раствор, содержащий одновременно: а) Ва(ОН)2 и HCl; б) СаСI2 и Na2СО3; в) NaCl и AgNO3 ; г) КСI и NaNO3. Указать, какие комбинации невозможны и почему.
Решение:
а) Ba(OH)2 и HCl – сильные электролиты, поэтому в водных растворах диссоциируют полностью:
Находящиеся в растворе ионы Ba 2+ и Cl – не связываются с ионами H + и OH – с образованием осадка, газа или слабого электролита. Поэтому раствор Ba(OH)2 и HCl будет существовать.
б) Растворимые соли CaCl2 и Na2CO3 как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ca 2+ и CO3 – связываются друг с другом, образуя осадок — не растворимая соль. В растворе останутся ионы Cl – и OH – , которые не связываются друг с другом, молекулами CaCO3 и ионами воды H + и OH — . Поэтому невозможно получить раствор, содержащий одновременно CaCl2 и Na2CO3, так как выпадает осадок СаСО3.
в) NaCl и AgNO3, как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ag + и Cl — связываются друг с другом, образуя осадок AgCl. В растворе остаются ионы Na + и NO3 — , которые не связываются друг с другом с молекулами AgCl, ионами воды H+ и OH- и не образуют осадок, газ или слабый электролит. Поэтому невозможно получить раствор, содержащий одновременно NaCl и AgNO3, так как выпадает осадок AgCl.
г) КСI и NaNO3 – растворимые соли, которые в водных растворах полностью распадаются на ионы:
KCl ⇔ K + + Cl — ;
NaNO3 ⇔ Na + + NO 3 — .
Образовавшиеся ионы K + , Na + , Cl — и NO 3 — не связываются друг с другом и ионами воды H + и OH — и не образуют осадок, газ или слабодиссоциируемое вещество. Таким образом, можно получить раствор одновременно содержащий КСI и NaNO3.
Задача 150.
Какие из перечисленных кислот образуют кислые соли: HJ, H2Se, H2SeO3, H2C2O4, CH3COOH.
Решение:
Кислые соли образуют многоосновные кислоты, в которых атомы водорода не все замещены на катионы кислоты. Так как кислоты HJ и CH3COOH содержат по одному катиону водорода в составе молекул, то они не могут образовать кислых солей. Кислоты H2Se, H2SeO3, H2C2O4 являются двухосновными кислотами, то они могут образовать кислые соли при замещении одного атома водорода на катион металла. При взаимодействии этих кислот с основаниями, в случае, если кислота взята в избытке, образуется кислая соль, например:
Названия кислых солей образуются, так же как и средних, но при этом добавляют приставку «гидро» и указывают наличие незамещённых атомов водорода, число которых обозначают греческими числительными («ди», «три» и т.д.). Например: NaH2HO4 — дигидроортофосфат натрия; KH2AsO4 – дигидроортоарсенат калия; Mg(HCO3)2 – гидрокарбонат магния.
Задача 151.
Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: Р2О5, СО2, N2O5, NO2, SO2?
Решение:
а) При взаимодействии P2O5 с водой могут образоваться различные кислоты, например метафосфорная HPO3 и ортофосфорная H3PO4:
б) При пропускании углекислого газа через воду образуется раствор слабой угольной кислоты H2CO3:
в) При растворении N2O5 в воде образуется азотная кислота HNO3 – сильный электролит.
г) при взаимодействии NO2 с водой может быть получена смесь двух кислот азотистой HNO2 и азотной HNO3:
В присутствии избытка кислорода в воде образуется только азотная кислота:
д) SO2 хорошо растворим в воде (36 об. ч. SO2 на 1 об. ч. Н2О при 20 0 С), при этом образуется сернистая кислота H2SO3 – кислота средней силы:
Задача 152.
С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(ОН)2, СаО, AgNO3, Н3РO3, Н2SO4? Составить уравнения реакций.
Решение:
а) Оксид азота (V) N2O5 является кислотным оксидом, поэтому не реагирует с соляной кислотой HCl.
б) гидроксид цинка Zn(ОН)2 является амфотерным основанием, поэтому реагирует как с основаниями, так и с кислотами. Реакция между Zn(ОН)2 и HCl протекает:
в) Оксид кальция СаО является основным оксидом, поэтому реагирует с соляной кислотой:
г) Нитрат серебра AgNO3 – сильный электролит, который в водных растворах диссоциирует на ионы Ag + и NO3 — , а соляная кислота как электролит распадается на ионы H + и Cl — . Ионы Ag + и Cl — , соединяясь, образуют нерастворимую соль AgCl, которая выпадает в осадок. Реакция между нитратом серебра и соляной кислотой протекает по схеме:
д) Ортофосфорная кислота Н3РO4, серная кислота H2SO4 и соляная кислота HCl – электролиты, которые в водных растворах распадаются на ионы:
Ионы PO4 3- , SO4 2- , H + и Cl — не связываются друг с другом, не образуют осадок, газ или малодиссоциируемое вещество. Поэтому Н3РO3 и Н2SO4 не реагируют с HCl.
Задача 153.
Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5. Составить уравнения реакций.
Решение:
а) Азотная кислота как кислота вступает в реакцию нейтрализации с основанием NaOH, при этом образуется соль и вода:
б) Оксид кальция СаО – основной оксид, поэтому не будет реагировать с NaOH – сильным основанием.
в) Оксид углерода (II) СО2 – кислотный оксид, поэтому будет реагировать с гидроксидом NaOH с образованием соли и воды:
г) CuSO4 и NaOH – сильные электролиты, поэтому в водных растворах распадаются на ионы:
CuSO4 ⇔ Cu 2+ + SO4 2- ;
NaOH ⇔ Na + + OH —
Ионы Cu 2+ и OH — связываются друг с другом, образуя осадок из нерастворимого Cu(OH)2. Значит, между CuSO4 и NaOH реакция протекает по уравнению:
д) Гидроксид кадмия Сd(OH)2 имеет слабо выраженные кислотные свойства, поэтому в растворе гидроксида натрия высокой концентрации при длительном кипячении образует неустойчивые гексагидроксокадмиат(I) – ионы [Cd(OH)6] 4- :
Сd(OH)2 + 4NaOH → Na4[Cd(OH)6]
Оксид фосфора(V) Р2О5 – кислотный оксид, поэтому будет реагировать с раствором гидроксида натрия с образованием соли и воды:
Задача 154.
Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3.
Решение:
Оксиды FeO, Cs2O, HgO, Bi2O3 имеют основной характер, поэтому все они растворяются в кислотах с образованием соли и воды:
Задача 155.
Написать уравнения реакций, доказывающих кислотный характер SеО2, SО3, Мn2O7, Р2O5, СrО3.
Решение:
Кислотные оксиды SеО2, SО3, Мn2O7, Р2O5 и СrО3 при взаимодействии с водой образуют соответствующие кислоты. Все они проявляют кислотные свойства, взаимодействуют как с основаниями, так и с основными оксидами:
Задача 156.
Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием кислоты на соль.
Решение:
Уравнения реакций получения хлорида магния:
а) Действием кислоты на металл:
б) Действием кислоты на основание:
в) Действием кислоты на соль:
Задача 157.
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Na2HPO4, K2S, Fe2(SO4)3.
Решение:
Уравнения реакций образования солей:
Задача 158.
Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций.
Решение:
а) При взаимодействии кислоты с солью могут быть получены кислота и соль, а также и другие вещества, например оксиды и вода:
б) При взаимодействии кислоты с основанием (реакция нейтрализации) образуются соль и вода:
в) Реакция между солями идёт, если при этом образуется малорастворимое соединение (реакция обмена). При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
- Галогениды серебра (кроме AgF):
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Составте уравнения реакций между кислотами и основаниями, приводящих к образованию солей : NaNO3, Ca(HCO3)2, MgOHCl?
Химия | 10 — 11 классы
Составте уравнения реакций между кислотами и основаниями, приводящих к образованию солей : NaNO3, Ca(HCO3)2, MgOHCl.
Составте по два уравнения химических реакций оснований формула ( KOH) 1)с кислотами 2) кислотными оксидами 3) с солями?
Составте по два уравнения химических реакций оснований формула ( KOH) 1)с кислотами 2) кислотными оксидами 3) с солями.
Составить уравнения реакций между соответствующими кислотами и основаниями, приводящих к образованию следующих солей : Fe(NO3)3, FeOHSO4, Ca(HS)2 если можно, с фото — объяснением?
Составить уравнения реакций между соответствующими кислотами и основаниями, приводящих к образованию следующих солей : Fe(NO3)3, FeOHSO4, Ca(HS)2 если можно, с фото — объяснением.
Привести пример (2 — 3) уравнение реакций свойства оснований, кислот, солей?
Привести пример (2 — 3) уравнение реакций свойства оснований, кислот, солей.
Напишите уравнение реакции между оксидом и основанием, приводящей к образованию соли и воды?
Напишите уравнение реакции между оксидом и основанием, приводящей к образованию соли и воды.
Приведите примеры реакций взаимодействия соляной кислоты с металлами, основными оксидами, основаниями, солями и напишите уравнения их реакций?
Приведите примеры реакций взаимодействия соляной кислоты с металлами, основными оксидами, основаниями, солями и напишите уравнения их реакций.
Напишите уравнение реакций кислот с основаниями с образованием солей и воды :H3PO4 + NaOH⇒HCl + Fe(OH)3⇒H2SiO3 + NaOH⇒HNO3 + Cu(OH)2⇒?
Напишите уравнение реакций кислот с основаниями с образованием солей и воды :
Помогите с химией пожалуйста?
Помогите с химией пожалуйста!
1. Напишите уравнение реакций образования основной соли и назовите её :
Гидроксид кобальта (2) + соляная кислота — >
Напишите уравнение реакций образования кислой соли и назовите её :
Гидроксид калия + сероводородная кислота — >
Гидроксид калия + фосфорная кислота — >.
Помогите составить уравнения химических реакция где исходные вещества металл и кислота ; металл и соль ; основной оксид и кислотный оксид (2 уравнения) ; основной оксид и кислота (2 уравнения) ; основ?
Помогите составить уравнения химических реакция где исходные вещества металл и кислота ; металл и соль ; основной оксид и кислотный оксид (2 уравнения) ; основной оксид и кислота (2 уравнения) ; основание и кислотный оксид (2 уравнения) ; основание и кислота (2 уравнения) ; основание и соль (2 уравнения) ; соль и кислота (2 уравнения) ; соль и соль.
Составте формулы всех солей, соответствующих кислотам и основаниям ;Ca (OH) 2, Сo (OH)3 , HNO2, H2S2O3Напишите уравнения реакций получения нормальных(средних) солей в молекулярной и ионной форме?
Составте формулы всех солей, соответствующих кислотам и основаниям ;
Ca (OH) 2, Сo (OH)3 , HNO2, H2S2O3
Напишите уравнения реакций получения нормальных(средних) солей в молекулярной и ионной форме.
Для амфотерных гидроксидов необходимо составлять формулы их солей, образованных при реакциях с кислотами и с основаниями.
Какую реакцию на лакмус покажут растворы солей, образованых : слабым основанием и сильной кислотой ; сильным основанием и слабой кислотой?
Какую реакцию на лакмус покажут растворы солей, образованых : слабым основанием и сильной кислотой ; сильным основанием и слабой кислотой?
На странице вопроса Составте уравнения реакций между кислотами и основаниями, приводящих к образованию солей : NaNO3, Ca(HCO3)2, MgOHCl? из категории Химия вы найдете ответ для уровня учащихся 10 — 11 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
http://chemege.ru/salts/
http://himia.my-dict.ru/q/8414528_sostavte-uravnenia-reakcij-mezdu-kislotami-i/