Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
Сернистый газ окисляют и другие окислители, например , озон или оксид азота (IV):
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
2. Серный ангидрид является типичным кислотным оксидом , взаимодействует с щелочами и основными оксидами.
Например , оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель , так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как йодид калия, сероводород или фосфор:
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Оксид серы (VI) SO3, серный ангидрид
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
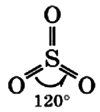
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
В таком виде молекула серного ангидрида может находиться только в газообразном состоянии.
В жидком и твердом состоянии происходит полимеризация молекул:
Физические свойства серного ангидрида:
- бесцветная жидкость;
- при температуре менее 16,8°C серный ангидрид превращается в белую кристаллическую массу;
- обладает высокой гигроскопичностью.
Химические свойства серного ангидрида
Оксид серы (VI) является типичным кислотным оксидом:
- с основаниями реагирует с образованием гидросульфатов (кислых солей) и сульфатов (средних солей):
- с основными оксидами реагирует с образованием сульфатов:
- с водой реагирует бурно, при этом образуется серная кислота:
Серный ангидрид очень хорошо растворяется в серной кислоте, образуя раствор, называемый олеумом:
В кислотно-восстановительных реакциях выступает в роли сильного окислителя, восстанавливаясь до сернистого ангидрида:
Получение и применение серного ангидрида
В промышленных целях серный ангидрид получают путем окисления сернистого газа в присутствии катализатора:
Серный ангидрид используют для получения серной кислоты, а также, в качестве сульфирующего и обезвоживающего реагента.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Оксиды серы. Общая характеристика, химические свойства
Большинство школьников знают два оксида серы — SO2 и SO3.
Однако, это не все соединения, которые сера образует с кислородом.
Рассмотрим их все.
Монооксид серы — SO
- Встречается только в виде разбавленной газовой фазы;
- после концентрирования превращается в S2O2 (диоксид дисульфита);
- SO имеет триплетное основное состояние, схожее с таковым у O2 , то есть каждая молекула имеет по два неспаренных электрона;
- молекула SO используется в реакциях органического синтеза (встраивается в молекулы алкенов, алкинов, диенов для получения молекул с трехчленными кольцами, содержащими серу);
- монооксид серы обнаружен на Ио — спутнике Юпитера, а также в атмосфере Венеры, в комете Хейла — Боппа (или «Большая комета 1997 года»);
- редко встречается в атмосфере Земли, поэтому токсичность в полной мере не выявлена;
- обладает высокой воспламеняемостью, горит до образования ядовитого сернистого газа SO2.
Дисульфид серы — SO2
- Токсичный газ, ответственен за запах сгоревших спичек;
- в природе образуется в результате вулканической активности;
- вне Земли встречается в атмосфере Венеры, где образует облака в результате конденсации, способствуя при этом глобальному потеплению на п ланете; а также на Ио, спутнике Юпитера (90% атмосферы)
- промышленное значение сернистого газа в основном заключается в производстве серной кислоты;
- SO2 может связываться с ионами металлов в качестве лиганда с образованием комплексов диоксида серы с металлом, обычно там, где переходный металл находится в степени окисления 0 или +1;
- обладает антимикробными свойствами, используется в качестве консерванта для кураги, инжира (E220);
- диоксид серы издавна применяется в производстве вина — служит антибиотиком и антиоксидантом, защищая вино от порчи и потемнения (окисления);
- сернистый газ является сильным восстановителем, при этом обладает отбеливающим эффектом;
- эндогенный диоксид серы играет важную физиологическую роль в регуляции работы сердца и кровеносных сосудов, а нарушение его метаболизма может привести к артериальной гипертензии, атеросклерозу, стенокардии.
Триоксид серы, серный ангидрид — SO3
- Является значительным загрязнителем, основной компонент кислотных дождей;
- имеет большое значение в промышленности, так как является прекурсором серной кислоты;
- в сухой атмосфере обильно дымит, без запаха, но едкий;
- на воздухе образуется прямым окислением сернистого газа;
- в лаборатории триоксид серы можно получить путем двухстадийного пиролиза бисульфата натрия:
- 2NaHSO4 → Na2S2O7 + H2O
Na2S2O7 → Na2SO4 + SO3
- серный ангидрид агрессивно гигроскопичен — теплота гидратации достаточна, чтобы смесь этого газа и древесины (или хлопка) могла воспламениться;
- при вдыхании вызывает ожоги, обладает высокой коррозионной активностью.
Тетроксид серы — SO4
- Этот оксид серы представляет собой группу химических соединений с формулой SO3 + Х, где Х лежит между 0 и 1;
- здесь содержатся пероксогруппы (О-О), а степень окисления серы как в триоксиде серы, +6;
- может быть выделен при низких температурах (78 К), после реакции SO3 с атомарным кислородом или фотолиза смесей SO3 — озон.
Монооксид дисеры, субоксид серы — S2O
- Представляет собой бесцветный газ, который при конденсации образует твердое вещество бледного цвета, нестабильное при комнатной температуре;
- Грамотрицательные бактерии Desulfovibrio desulfuricans способны производить S2O;
- был обнаружен Питером Шенком в 1933 году.
Пoсле краткого обзора оксидов серы прилагаю таблицу двух важнейших оксидов серы — сернистого газа и серного ангидрида, так как именно они по большей части встречаются в заданиях ЕГЭ и ОГЭ по Химии.
http://prosto-o-slognom.ru/chimia/503_oksid_sery_SO3.html
http://pangenes.ru/post/oksidy-sery-obshchaya-harakteristika-himicheskie-svoystva.html