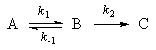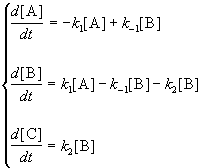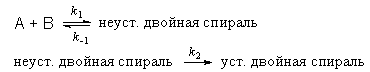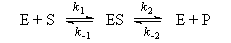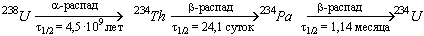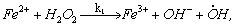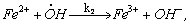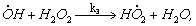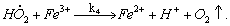Составление кинетических уравнений для известного механизма реакции
Для большинства сложных реакций, включающих несколько элементарных стадий, кинетические уравнения обычно настолько сложны, что их можно точно решить только численным интегрированием. В то же время, разные константы скорости, входящие в эти уравнения, отличаются друг от друга во много раз, что позволяет при решении кинетических уравнений использовать приближенные методы.
Мы рассмотрим два основных метода — метод квазистационарных (иногда просто — стационарных) концентраций и квазиравновесное приближение — на примере кинетической схемы:
1. Приближение квазистационарных концентраций применяют в том случае, когда в ходе реакции образуются неустойчивые промежуточные вещества. Если скорость распада этих веществ намного превышает скорость их образования, то концентрация веществ в любой момент времени мала. Раз мала концентрация, то мала и скорость ее изменения, которую приближенно принимают равной 0. Условие квазистационарности позволяет выражать концентрацию промежуточных веществ через концентрации исходных веществ и тем самым упрощать кинетические уравнения.
Для приведенной выше схемы система кинетических уравнений имеет вид:
Если k2 >> k1, то B — неустойчивое промежуточное вещество, концентрацию которого можно считать квазистационарной:
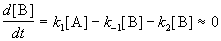
откуда 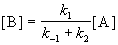
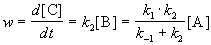
Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
Приближение квазистационарных концентраций обычно применяется к реакциям с участием свободных радикалов, которые представляют собой реакционноспособные неустойчивые частицы.
2. Квазиравновесное приближение применяют в том случае, когда одна из реакций — обратимая, причем равновесие быстро устанавливается и медленно разрушается. Для приведенной выше схемы это означает, что k2 . + H . + M (k1)
H . + п-H2 
H . + H . + M 
Используя метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
Решение. Из второго уравнения следует, что скорость образования орто-водорода равна:
Для того, чтобы решить задачу, надо исключить из этого выражения концентрацию неустойчивого вещества — атомов водорода. Это можно сделать, приняв, что она не изменяется со временем:
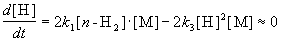
откуда 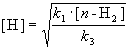
При оценке скорости изменения концентрации [H] мы учли, что в первой и третьей реакциях образуются и расходуются по два атома H, а во второй реакции число атомов H не изменяется. Подставляя концентрацию [H] в выражение для скорости реакции, получаем окончательный результат:
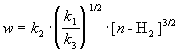
Из этого результата мы видим, как в сложной реакции может получиться дробный порядок.
Пример 6-2. Механизм ренатурации ДНК из двух ветвей спирали имеет вид:
Предполагая, что первая стадия — быстрая, а вторая — медленная, выведите уравнение для скорости образования устойчивой двойной спирали и выразите общую константу скорости реакции через константы скорости элементарных стадий.
Решение. Условия задачи позволяют применить квазиравновесное приближение. Концентрация неустойчивой двойной спирали в этом приближении равна:
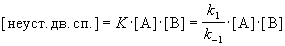
Скорость реакции определяется скоростью второй стадии:
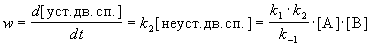
Образование устойчивой двойной спирали ДНК — реакция второго порядка с эффективной константой скорости k = k1 . k2 / k-1.
6-1. Механизм некоторой ферментативной реакции имеет вид:
Используя метод квазистационарных концентраций для комплекса фермента с субстратом, выразите скорость образования продукта через текущие концентрации фермента, субстрата и продукта.(ответ)
6-2. Для реакции NO2Cl 
NO2Cl 
NO2Cl + Cl . 
Используя метод квазистационарных концентраций, выведите уравнение для скорости разложения NO2Cl.(ответ)
6-3. Для реакции синтеза иодоводорода из простых веществ H2 + I2 
I2 
2I . 
2I . + H2 
Используя квазиравновесное приближение, выведите уравнение для скорости образования HI и покажите, что данная реакция имеет второй порядок.(ответ)
6-4. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: A + A 
дезактивация: A + A* 
распад: A* 
Используя метод квазистационарных концентраций, выведите уравнение для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].(ответ)
6-5. Для тримолекулярной реакции 2NO + O2 
2NO 
(NO)2 + O2 
Определите порядок суммарной реакции, предполагая, что первая стадия — быстрая, а вторая — медленная.(ответ)
6-6. Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбаниона C3H5O — . Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощенный механизм выглядит так:
AH + B 
A — + BH + 
A — + AH 
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение для скорости образования продукта.(ответ)
6-7. Составьте кинетические уравнения для следующего механизма газофазной реакции:
A 

Определите скорость образования продукта в приближении квазистационарных концентраций. Покажите, что при высоких давлениях реакция может протекать по первому порядку, а при низких давлениях — по второму порядку.(ответ)
6-8. Химическая реакция N2O 
N2O + M 
N2O* 
N2O* + M 
N2O + O . 
Считая концентрации N2O* и O . стационарными, найдите выражение для скорости распада N2O.(ответ)
6-9. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + N2O5 
6-10. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + NO3 
Указание. Интермедиаты — NO и NO3.(ответ)
6-11. Дана схема цепной реакции:
AH 
A . 
AH + B . 
A . + B . 
Назовите стадии зарождения, развития и обрыва цепи. Используя метод квазистационарных концентраций, покажите, что образование продукта P описывается кинетическим уравнением первого порядка.(ответ)
6-12. Дана кинетическая схема:
CH4 + M 
CH3 . + CH4 
H . + CH4 
H . + CH3 . + M 
(M — инертная молекула). Используя метод квазистационарных концентраций, выразите скорость образования этана через концентрацию метана.(ответ)
6-13. Реакция разложения бромметана 2CH3Br 
CH3Br 
CH3 . + CH3Br 
Br . + CH3Br 
2CH3 . 
Используя метод стационарных концентраций, найдите выражение для скорости образования этана.(ответ)
6-14. Термическое разложение углеводорода R2 протекает по следующему механизму:
R2 
R . + R2 
R’ . 
2R . 
где R2, PA, PB — устойчивые углеводороды, R . и R’ . — радикалы. Найдите зависимость скорости разложения R2 от концентрации R2.(ответ)
6-15. Дана кинетическая схема разложения ацетальдегида:
CH3CHO 
CH3 . + CH3CHO 
CH2CHO . 
CH3 . + CH3 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования метана и скорости расходования ацетальдегида.(ответ)
6-16. Реакцию радикального дегидрирования этана можно описать с помощью механизма Райса-Герцфельда, который включает следующие стадии:
инициирование: CH3CH3 
развитие цепи: CH3 . + CH3CH3 
CH3CH2 . 
H . + CH3CH3 
обрыв цепи: H . + CH3CH2 . 
Найдите уравнение для скорости образования этилена, если константа k1 мала. Как можно изменить условия, чтобы изменился порядок?(ответ)
6-17. Дана кинетическая схема дегидрирования этана:
C2H6 
CH3 . + C2H6 
C2H5 . 
H . + C2H5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования этилена.(ответ)
6-18. Химическая реакция 2C2H6 
C2H6 
H . + C2H6 
C2H5 . + C2H6 
2C2H5 . 
Используя метод стационарных концентраций, получите выражение для скорости образования бутана.(ответ)
6-19. Дана кинетическая схема радикального хлорирования тетрахлорэтилена в растворе CCl4:
Cl2 
Cl . + C2Cl4 
C2Cl5 . + Cl2 
2C2Cl5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования гексахлорэтана.(ответ)
6-20. Реакция образования фосгена CO + Cl2 
Cl2 
2Cl . 
CO + Cl . 
COCl . 
COCl . + Cl2 
Используя метод стационарных концентраций, найдите выражение для скорости образования фосгена.(ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Составление кинетических уравнений для известного механизма реакции
1. ФОРМАЛЬНАЯ КИНЕТИКА
1.5. Приближённые методы решения кинетических уравнений. Метод квазистационарных концентраций. Квазиравновесное приближение
1.5.1. Найдите точное решение прямой кинетической задачи для реакции, протекающей по механизму
А 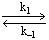
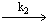
Покажите, как это решение переходит в приближённое решение, соответствующее методу стационарных концентраций. Начальные концентрации веществ: 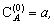
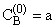
1.5.2. При каких ограничениях на концентрации и константы скорости метод стационарных концентраций применим для описания реакции
A + B 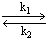
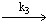
1.5.3. При каких соотношениях между константами можно использовать метод стационарных концентраций для описания процесса
2 A 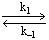
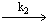
1.5.4. На примере сложной реакции
А 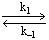
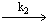
продемонстрируйте использование метода стационарных концентраций. Укажите условия его применимости.
1.5.5. Определите условие применимости метода стационарных концентраций для описания кинетики сложной реакции
3 А 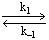
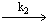
1.5.6. Определите условие применимости метода стационарных концентраций для описания кинетики сложной реакции
А + 2 В 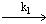
C + D 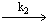
если 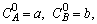
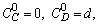
1.5.7. При каких соотношениях между константами можно использовать метод стационарных концентраций для описания процесса
A 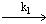
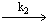
1.5.8. Выведите условие применимости метода стационарных концентраций для описания кинетики реакции, протекающей по механизму
2 A 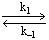
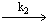
Какой порядок имеет эта реакция в стационарных условиях? Как её эффективная константа скорости связана с константами скорости отдельных стадий? Какому режиму протекания реакции соответствует случай k 2 k –1 ?
1.5.9. Определите условие применимости метода стационарных концентраций для описания кинетики сложной реакции
A + B 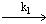
C + D 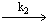
если 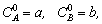
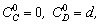
1.5.1. Превращение изотопа 238 U в изотоп 234 U состоит из трёх последовательных ядерных реакций:
Какова будет доля 234 Th в смеси изотопов 238 U, 234 Th, 234 Pa и 234 U через 10, 20, 40 и 80 дней после начала распада чистого 238 U? Через t 1/2 обозначены времена полураспада изотопов.
1.5.2. Реакция выделения H2 из растворов дважды восстановленных форм K H 2 гетерополикислот идёт по механизму
KH 2 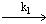
K + KH2 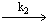
где K – активное промежуточное вещество.
Найдите выражения для изменения концентраций веществ KH 2 и H 2 во времени. Чему равна константа скорости k1, если время полупревращения вещества KH 2 равно 20 мин?
Найдите условие применимости метода стационарных концентраций для рассматриваемой реакции. Каково время установления стационарной концентрации вещества K ?
1.5.3. Реакция перекиси водорода с ионами Fe 2+ происходит по схеме
Константы скоростей стадий приведены в таблице:
Найдите выражения для скоростей выделения О2 и расходования Fe 2 + и Н2 О2, полагая, что радикалы 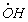
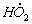
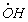
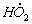
1.5.4. Термическое разложение гидроперекиси ROOH протекает по механизму
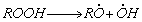
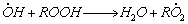

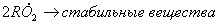
Определите квазистационарные концентрации промежуточных частиц и скорость разложения гидроперекиси при C ROOH = 0,1 M. Выведите условия применимости метода квазистационарных концентраций в данном случае.
1.5.5. Окисление гидрохинона ( QH2) хлорноватистой кислотой в буферном растворе (рН > 7) протекает по следующему механизму:
1) 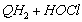
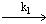
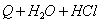
2) 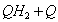
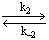
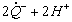
Найдите зависимость концентрации 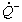
1.5.6. Механизм окислительно-восстановительного взаимодействия V 3+ и Cr 2+ в водных растворах в общих чертах описывается следующей схемой:
V 3+ + Cr 2+ + H 2 O 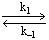
[ V ( OH ) Cr] 4+ 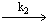
Cr ( OH ) 2+ + H + 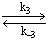
Получите зависимость скорости восстановления ванадия и скорости накопления Cr 3+ от [ H + ], считая, что [ V ( OH ) Cr ] 4+ – высокореакционноспособная частица.
1.5.16. При холоднопламенном окислении бутана углекислый газ может получаться как при окислении СО (со скоростью W1), так и за счёт распада ацильных перекисных радикалов на СО2 и радикалы R O · (скорость W2). Определите отношение скоростей этих процессов из результатов следующего эксперимента (кинетический изотопный метод). Сразу после установления стационарного режима реакции в реагирующую смесь добавили некоторое количество СО, меченого радиоактивными атомами 14 С, так, что ее полная радиоактивность составила 75 мКюри/моль. В дальнейшем отдельно измеряли радиоактивность СО2, образующегося в ходе окисления. Её значение на начальном этапе реакции составило 3 мКюри/моль.
Какое заключение о механизме реакции можно было бы сделать, если бы в этом эксперименте радиоактивности СО и СО2 в тех же условиях оказались равными?
1.5.17. Окисление органического соединения A комплексами Pd (II) в водных растворах описывается схемой
1) 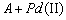
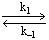
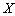
2) 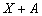

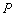
Получите выражение для кинетической кривой накопления 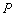
1.5.18. Реакция А + B ¾ ® D осуществляется в результате двух последовательных стадий:
1) А 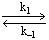
2) Х + B 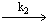
Получите выражение, описывающее зависимость концентрации вещества D от времени, если реакция (2) медленная, а стадия (1) практически равновесная; [ A]0 = a, [ B ]0 = a, [ D]0 = 0.
1.5.19. Разложение N2 O5 в газовой фазе описывается схемой
1) N2 O5 
Получите выражение для скорости реакции как функции концентрации N2 O5 и NO2 в квазистационарном и квазиравновесном приближении. Определите условия применимости этих приближений в каждом случае.
1.5.20. Разложение NO2 C l протекает по механизму
Получите выражение для скорости реакции в квазистационарном приближении.
1.5.21. Синтез фосгена по реакции CO + Cl2 ¾ ® COCl 2 протекает по механизму
Cl 2 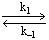
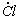

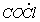
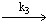
Выведите выражение для скорости реакции, если известно, что 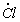
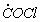
1.5.22. Реакция распада озона 2 O3 ¾ ® 3 O2 происходит по механизму
O 3 + M 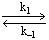
O + O3 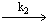
Пользуясь методом стационарных концентраций, выведите уравнение для скорости реакции. Чему равен порядок реакции по озону и веществу М в предельных случаях k 2 [ O 3 ] >> k –1 [ O 2 ][ M ] и k 2 [ O 3 ] k –1 [ O 2 ][ M ]?
1.5.23. В результате исследования кинетических закономерностей реакции окислительного хлорирования ацетилена в водных растворах CuCl2 и CuCl установлено, что суммарный порядок реакции при некоторых условиях равен 3.
Объясните этот факт исходя из следующей кинетической схемы
1) A + CuCl 
Здесь А – ацетилен, Р – продукт RC º CCl , а Х1, Х2 – промежуточные вещества.
1.5.24. (КР1–1997, № 5). Взаимодействие атомарного кислорода с формальдегидом включает реакции:
1) 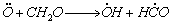

3) 

При начальных условиях [ CH 2 O ] = 10 16 см –3 , [ O ] = 2 × 10 13 см –3 было получено, что [ CO 2 ] = 4 × 10 11 см –3 , если отношение [ O ]/[ O ]0 = 0,68.
Принимая, что 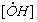
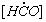
1.5.25. (КР1–1998, № 1). Для реакции, идущей по механизму

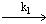

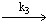
1.5.26. (КР1–2000, № 1). Для следующей кинетической схемы найдите зависимости от времени концентрации веществ C и B в квазиравновесном приближении:
A 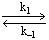
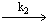
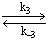
Начальные концентрации равны: CA 0 = a , CB 0 = CC 0 = CD 0 = 0.
1.5.27. (КР1–2002, № 3). Найдите уравнение кинетической кривой для промежуточного продукта B , появляющегося в реакции:
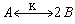
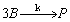
Равновесие устанавливается быстро. При t = 0 A = A 0 , B = P = 0.
1.5.28. (КР1–2000, № 2). Взаимодействие СО с озоном в атмосфере кислорода при T = 100 ° C протекает по механизму
O 3 + M 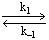
O 3 + O 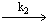
O + CO 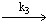
Найдите зависимость скорости реакции от концентрации реагентов в квазистационарном приближении.
1.5.29. (КР1–2000, № 5). Реакция ClO 2 + Co ( II ) ® ClO 2 – + Co ( III ) в водных растворах протекает согласно следующему механизму:
1) ClO 2 + Co ( II ) 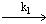
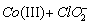
2) CO(III) + Co(II) 
3) ClO2(III) + Coa 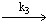
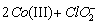
где Co a – комплекс неопределённой структуры, [ Co ( II )] 0 = 2 × 10 –4 M , [ ClO 2 ]0 = 2 × 10 –4 M . Определите скорость реакции в момент времени, когда [ Co(II)] = 10 –4 M . Справедливо ли применение метода стационарных концентраций в данном случае?
1.5.30. (Экз–2003, № 4). Вещество X в водном растворе представлено в двух таутомерных формах А и В, которые находятся в равновесии (К = 0,25). Обе формы претерпевают мономолекулярные превращения по схеме
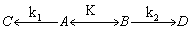
В начальный момент времени был приготовлен водный раствор X с концентрацией 0,74 М , найдите концентрацию X через 10 мин.
1.5.31. (КР1–2004, № 1). Гидролиз изоцианатов может протекать по одному из двух механизмов, в каждом из которых лимитирующей стадией является образование карбаминовой кислоты. Концентрации промежуточных комплексов X 1 и X 2 предполагаются квазистационарными. Р – продукты, Ac – кислота. Получите выражения для скорости реакции для двух предполагаемых механизмов.
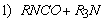

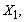
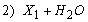

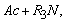
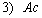

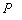
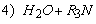

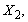
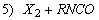

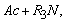
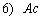

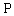
1.5.32. (КР1–2003, № 2). Комплекс Co II устойчив в растворе чистого CHCl 3 . Однако если в системе присутствует метанол, то Co II окисляется по схеме
Co II + MeOH 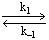
X II + O2 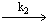
X III 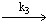
где X II º [ Co II ( MeOH ) ], X III º [ Co III O2 ( MeOH ) ], P + º [ Co III ( MeOH ) ] + .
Не знавший об этом студент приготовил 10 –3 М раствор Co II в хлороформе, содержащем 0,11 М метанола, и ушел на обед. Оцените, через какое время содержание кобальта ( II ) составит 50 % от исходного количества кобальта, если раствор насыщен кислородом до концентрации 5 × 10 –2 М, а равновесие в первой реакции устанавливается быстро, X III – высокореакционноспособная частица.
1.5.33. (Пе1–2003, № 4). Реакция конверсии пара-водорода в орто-водород протекает по следующему механизму ( M – инертная частица):
p-H 2 + M 
H · + p-H 2 
H · + H · + M 
Используя метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
1.5.34. (КР1–2002, № 5). В системе присутствует вещество А с концентрацией А 0 , которое может вступать в химические превращения по схеме
A 
2 B 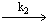
где B – очень реакционноспособная частица.
Определите условие применимости метода квазистационарных концентраций. Найдите выражение для скорости образования С в момент времени, когда концентрация А равна концентрации С.
1.5.35. (КР1–2001, № 2). Для последовательной схемы превращения
2 A 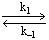
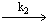
известны значения констант скорости и энергии активации:
http://fen.nsu.ru/posob/phys_ch/Chem_kinet/1-5-MKSK-MKRP.htm