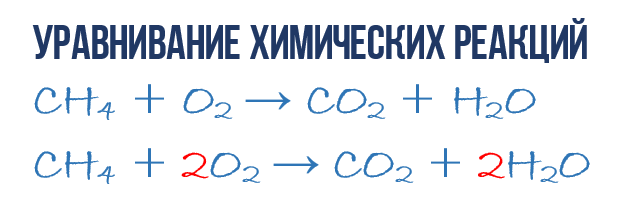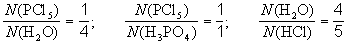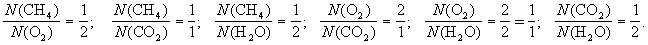Составление уравнений химических реакций глава 2
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 2-1
Расставьте коэффициенты, преобразовав схемы в уравнения реакций:
а) S8 ⟶ S4;
S8 = 2S4
б) O2 ⟶ O3.
3O2 = 2O3
Задание 2-3
Расставьте коэффициенты, преобразовав схемы в уравнения реакций.
| Ca + S = CaS 2 Al + 3 S = Al2S3 Al + P = AlP 3 Ca + 2 P = Ca3P2 4 K + O2 = 2 K2O Mg + Cl2 = MgCl2 H2 + Cl2 = 2 HCl N2 + O2 = 2 NO 2 Na + H2 = 2 NaH | 2 AgCl = 2 Ag + Cl2 Zn + Br2 = ZnBr2 2 Al + 3 Cl2 = 2 AlCl3 4 Al + 3 O2 = 2 Al2O3 2 Fe + 3 Cl2 = 2 FeCl3 2 O2 + 3 Fe = Fe3O4 2 HgO = 2 Hg + O2 2 Ag2O = 4 Ag + O2 2 Au2O3 = 4 Au + 3 O2 | 5 O2 + 4 P = 2 P2O5 N2 + 6 Li = 2 Li3N 2 H2 + O2 = 2 H2O N2 + 3H2 = 2NH3 2 B + 3 F2 = 2 BF3 2 CO + O2 = 2 CO2 2 SO2 + O2 = 2 SO3 2 FeCl3 + 2 Fe = 3 Fe 2 FeCl2 + Cl2 = 2 FeCl3 |
Задание 2-4
Расставьте коэффициенты, преобразовав схемы в уравнения реакций.
1) H2O + P2O5 = 2 HPO3
2) B2O3 + 3H2O = 2 H3BO3
3) Na2O + H2O = 2 NaOH
4) P2O5 + 3 H2O = 2 H3PO4
Задание 2-5
Расставьте коэффициенты, преобразовав схемы в уравнения реакций.
а) Fe + CuCl2 = Cu + FeCl2
3 Zn + 2 FeBr3 = 3 ZnBr2 + 2 Fe
3 HgCl2 + 2 Al = 2 AlCl3 + 3 Hg
Mg + 2 H2O = H2 + Mg(OH)2
б) Fe2O3 + 3 H2 = 3 H2O + 2 Fe
3 PbO + 2 Al = Al2O3 + 3 Pb
Cr2O3 + 3 Mg = 3 MgO + 2 Cr
2 Al + 6 H2O = 2 Al(OH)3 + 3H2
Задание 2-7
Расставьте коэффициенты, преобразовав схемы в уравнения реакций.
а) Mg + 2 HCl = H2 + MgCl2
4 HI + O2 = 2I2 + 2 H2O
10 Al + 3 V2O5 = 5 Al2O3 + 6V
Br2 + 2 KI = 2 KBr + I2
б) 6 HCl + 2 Al = 2 AlCl3 + 3 H2
2 Al + WO3 = W + Al2O3
I2 + H2S = S + 2 HI
2 F2 + 2H2O = 4 HF + O2
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Составление уравнений химических реакций глава 2
При химических реакциях одни вещества превращаются в другие. Вспомним известную нам реакцию серы с кислородом. И в ней из одних веществ (исходных веществ или реагентов) образуются другие (конечные вещества или продукты реакции).
Для записи и передачи информации о химических реакциях используются схемы и уравнения реакций.
Схема химической реакции – условная запись,дающая качественнуюинформацию о химической реакции.
Схема реакции показывает, какие вещества вступают в реакцию и какие образуются в результате реакции. И в схемах, и в уравнениях реакций вещества обозначаются их формулами.
Схема горения серы записывается так: S8 + O2 SO2.
Это означает, что при взаимодействии серы с кислородом протекает химическая реакция, в результате которой образуется диоксид серы (сернистый газ). Все вещества здесь молекулярные, поэтому при записи схемы использованы молекулярные формулы этих веществ. То же относится и к схеме другой реакции – реакции горения белого фосфора:
P4 + O2 P4O10.
При нагревании до 900 o С карбоната кальция (мела, известняка) протекает химическая реакция: карбонат кальция превращается в оксид кальция (негашеную известь) и диоксид углерода (углекислый газ) по схеме:
CaCO3 CaO + CO2.
Для указания на то, что процесс происходит при нагревании, схему (и уравнение) обычно дополняют знаком » t« , а то, что углекислый газ при этом улетучивается, обозначают стрелкой, направленной вверх:
CaCO3 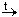
Карбонат кальция и оксид кальция – вещества немолекулярные, поэтому в схеме использованы их простейшие формулы, отражающие состав их формульных единиц. Для молекулярного вещества – углекислого газа – использована молекулярная формула.
Рассмотрим схему реакции, протекающей при взаимодействия пентахлорида фосфора с водой: PCl5 +H2O H3PO4 + HCl.
Из схемы видно, что при этом образуется фосфорная кислота и хлороводород.
Иногда для передачи информации о химической реакции бывает достаточно и краткой схемы этой реакции, например:
S8 SO2; P4 P4O10; CaCO3 CaO.
Естественно, что краткой схеме может соответствовать и несколько разных реакций.
Уравнение химической реакции – условная запись, дающая качественную и количественную информацию о химической реакции.
Для любой химической реакции справедлив один из важнейших законов химии:
При протекании химических реакций атомы не появляются, не исчезают и не превращаются друг в друга.
При записи уравнений химических реакций, кроме формул веществ, используются коэффициенты. Как и в алгебре, коэффициент «1» в уравнении химической реакции не ставится, но подразумевается. Рассмотренные нами реакции описываются следующими уравнениями:
Знак равенства между правой и левой частью уравнения означает, что число атомов каждого элемента, входящих в состав исходных веществ, равно числу атомов этого элемента, входящих в продукты реакциии.
Коэффициенты в уравнении химической реакции показывают отношение между числом реагирующих и числом образующихся молекул (для немолекулярных веществ – числом формульных единиц) соответствующих веществ. Так, для реакции, протекающей при взаимодействии пентахлорида фосфора с водой
и так далее (всего 6 пропорций).Обычно отдельный коэффициент в уравнении реакции не имеет никакого смысла, но в некоторых случаях может означать число молекул или формульных единиц данного вещества.Примеры информации, даваемой схемами и уравнениями реакций.
1-й пример. Реакция горения метана в кислороде (или на воздухе):
СН4 + O2 CO2 + H2O (схема),
СН4+ 2O2 = CO2 + 2Н2О (уравнение).
Схема химической реакции показывает, что (1) в реакции, протекающей между метаном и кислородом, образуются углекислый газ и вода.
Уравнение реакции добавляет, что (2) число молекул метана, вступившего в реакцию, относится к числу молекул вступившего в реакцию кислорода, как 1 к 2, и так далее, то есть:
Кроме того, уравнение показывает, что одна молекула метана реагирует с двумя молекулами кислорода, при этом образуется одна молекула углекислого газа и две молекулы воды.
2-й пример. Восстановление железа водородом из его оксида:
Fe2O3 + H2 Fe + H2O (схема),
Fe2O3 + 3H2 = 2Fe + 3H2О (уравнение).
Схема химической реакции показывает, что (1) при взаимодействии оксида железа(Fe2O3) с водородом (которое происходит при нагревании) образуются железо и вода.
Уравнение добавляет к этому, что (2) число формульных единиц оксида железа, вступившего в реакцию, относится к числу вступивших в реакцию молекул водорода, как 1 к 3, и так далее. То есть:
Кроме того уравнение показывает, что одна формульная единица оксида железа реагирует с тремя молекулами водорода, при этом образуется два атома железа и три молекулы воды.
Как вы узнаете в дальнейшем, уравнения реакций дают нам и другую количественную информацию.
| Карбонат кальция – CaCO3. Бесцветное немолекулярное вещество, нерастворимое в воде. Такие широко известные горные породы, как мрамор и известняк, состоят в основном из карбоната кальция. Мел, которым вы пишете на доске, – тоже карбонат кальция: многие морские организмы (радиолярии и др.) строят свои панцири из этого вещества; за длительное время на дне океана формируются залежи мела, представляющего собой огромные слои спрессованных панцирей этих организмов. Карбонат кальция не обладает способностью плавиться – при нагревании он разлагается. Горные породы, образуемые карбонатом кальция, используются в строительстве в качестве отделочных материалов, строительного камня, а также для производства негашеной извести (CaO). В металлургии карбонат кальция в виде известняка добавляют в руду для лучшего образования шлаков. |


1.Запишите уравнения, соответствующие следующим схемам реакций:
а) Na+ Cl2 NaCl; б) CuO + Al Al2O3 + Сu;
в) N2O N2 + O2; г)NaOH + H2SO4 Na2SO4 + H2O.
2.Какую информацию передают составленными вами уравнениями реакций (среди приведенных веществ молекулярными являются Cl2, N2О, N2, O2, H2SO4 и H2O; остальные – немолекулярные).
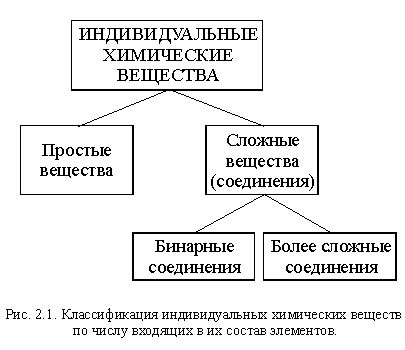
Вы уже познакомились в той или иной степени примерно с пятьюдесятью индивидуальными (чистыми) химическими веществами. Всего же науке известно несколько миллионов таких веществ. Чтобы не утонуть в этом » море» веществ, их необходимо систематизировать и прежде всего классифицировать – классифицировать более подробно, чем мы делали это в параграфе 1.4 (рис. 1.3).
Вещества отличаются друг от друга своими свойствами, а свойства веществ определяются составом и строением. Поэтому важнейшие признаки, по которым классифицируют вещества – состав, строение и свойства.
По составу, а точнее, по числу входящих в их состав элементов, вещества делятся на простые и сложные (это вы уже знаете). Сложных веществ в сотни тысяч раз больше, чем простых, поэтому среди них выделяют бинарные вещества (бинарные соединения).
Бинарные вещества (бинарные соединения) – сложные вещества,в состав которых входят атомы двух элементов.
Схема этой классификации приведена на рисунке 2.1.
Признаком, по которому проводят дальнейшую классификацию веществ, являются их свойства.
Начнем с простых веществ.
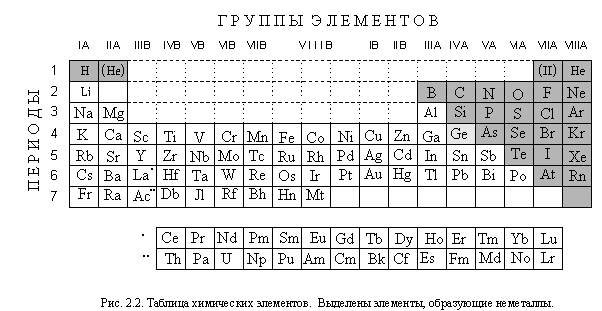
По физическим свойствам простые вещества делятся на металлы и неметаллы.
Характерные физические свойства металлов:
1) высокая электропроводность (способность хорошо проводить электрический ток),
2) высокая теплопроводность (способность хорошо проводить теплоту),
3) высокая пластичность (ковкость, изгибаемость, вытягиваемость).
Кроме того все металлы обладают » металлическим» блеском. Но следует помнить, что таким блеском обладают не только металлы, но и часть неметаллов, и даже некоторые сложные вещества. Блестит кристаллический кремний, одна из полиморфных модификаций мышьяка, теллур, а это всё – неметаллы. Из сложных веществ – пирит FeS2, халькопирит CuFeS2 и некоторые другие.
Основой систематизации химических элементов, простых веществ и соединений служит ЕСТЕСТВЕННАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, открытая в 1869 году выдающимся русским химиком Дмитрием Ивановичем Менделеевым (1834 –1907) и названная им » периодической системой» . Усовершенствованная многими поколениями ученых, эта система продолжает называться » периодической» , хотя это и не совсем правильно. Графически система химических элементов выражается в виде таблицы элементов (рис. 2.2); со строением этой таблицы вы подробно познакомитесь, изучая главу 6. Пока же посмотрим, где в таблице элементов расположены элементы, образующие неметаллы, а где – элементы, образующие металлы. Оказывается, элементы, образующие неметаллы, группируются в правом верхнем углу таблицы элементов. Все остальные элементы – элементы , образующие металлы. Причину этого вы узнаете, изучив строение атомов и химические связи.
При комнатной температуре металлы – твердые вещества (исключение – ртуть, ее температура плавления – 39 o С).
В отличие от металлов, неметаллы не обладают каким-либо определенным набором характерных физических характеристик. Даже агрегатное состояние у них может быть разным. При комнатной температуре газообразныдвенадцать простых веществ (Н2, Не, N2, O2, O3, F2, Nе, Cl2, Аr, Кr, Хе, Rn), жидкость одна (Br2), а твердых веществ – более десяти (В, С(алмаз), С(графит), Si, P4, S8, As, Se, Те, I2 и др.). По своим химическим свойствам большинство металлов сильно отличается от большинства неметаллов, но резкой границы между ними нет.
Многие простые вещества при определенных условиях могут вступать в реакции друг с другом, например:
В результате таких реакций образуются бинарные соединения.
В принципе, в состав бинарного соединения могут входить любые элементы (кроме гелия и неона). Но часто один из этих элементов – кислород, водород или один из галогенов (фтор, хлор, бром или йод). Такие вещества называются кислородными соединениями, водородными соединениями или галогенидами. Примеры бинарных соединений: CaO, Al2O3, КН, HCl, АlI3, СаС2.
| Кислородное соединение – бинарное соединение, один из элементов в котором кислород. |
Примеры кислородных соединений: H2O (вода), H2O2 (пероксид водорода), Na2O (оксид натрия), Na2O2 (пероксид натрия), СО2 (диоксид углерода), OF2 (фторид кислорода). Большинство кислородных соединений является оксидами. Чем оксиды отличаются от остальных кислородных соединений, вы узнаете позже.
Примеры оксидов:
Li2O – оксид лития, CO2 – диоксид углерода, CaO – оксид кальция, SiO2 – диоксид кремния, Al2O3 – оксид алюминия, Н2О – вода,
MnO2 – диоксид марганца, SO3 –триоксид серы.
| Водородное соединение – бинарное соединение, один из элементов в котором водород. |
Примеры водородных соединений: NаН – гидрид натрия, H2O – вода, КН – гидрид калия, НСl – хлороводород, СаH2 – гидрид кальция,
NH3 – аммиак, BaH2 – гидрид бария, CH4 – метан.
Галогенид (фторид, хлорид, бромид или – бинарное соединение,один из элементов в котором – галоген.
Примеры галогенидов: CaF2 – фторид кальция, BF3 – трифторид бора, NaCl – хлорид натрия,PCl5 – пентахлорид фосфора, КВr – бромид калия, НВr – бромоводород, AlI3 – йодид алюминия, HI – йодоводород.
Примеры названий бинарных соединений приведены в таблице 6.
http://himi4ka.ru/arhiv-urokov/urok-13-sostavlenie-himicheskih-uravnenij.html
http://www.chem.msu.su/rus/school/zhukov1/02a.html