Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
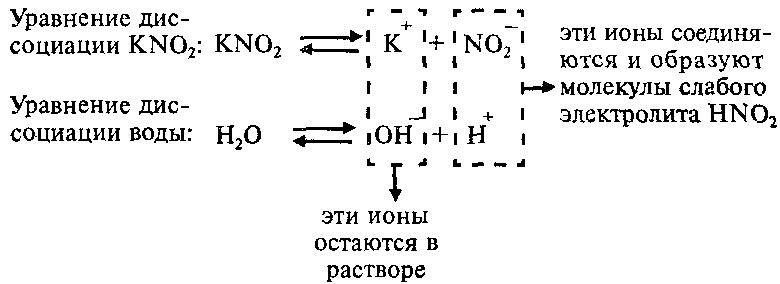
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
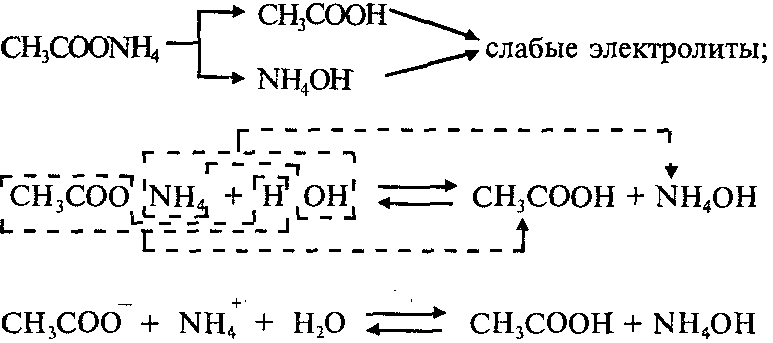
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
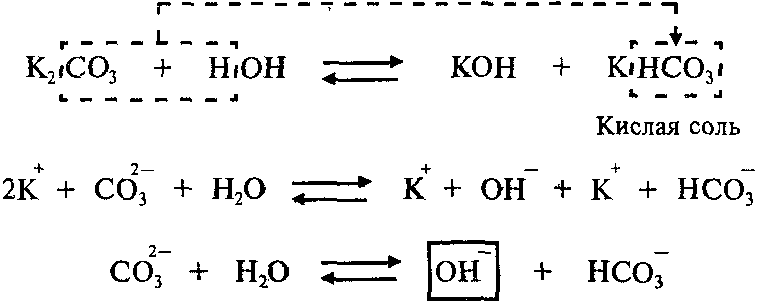
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Серия уроков по теме «Гидролиз»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Для определения темы урока ответим на ряд вопросов. Односложные ответы запишем строго друг под другом. Слово, сложенное из первых букв и будет темой нашего урока.
Процесс окружения ионов молекулами воды?
Как называются заряженные частицы, образующиеся при диссоциации электролитов?
Как называется процес распада электролита на ионы?
Реакция при которой из одного сложного вещества образуется несколько новых называется?
Процес взаимодействия вещества с кислородом без выделения света называется?
Элемент с атомным весом 7 называют?
Объединенное название газов главной подгруппы VIII группы?
Реакция между простым и сложным веществами называется?
Тема урока: Гидролиз- взаимодействие соли с водой,приводящее к образованию слабого электролита
Гидро — вода, лиз— разлагать. Сравните- электролиз, пиролиз…
Вещества, растворы и расплавы которых проводят электрический ток
Н/р: р-ры кислот, солей, оснований
Что позволяет электролитам проводить эл. ток?
Наличие заряженных частиц, т.к. эл. ток это направленное движение заряженных частиц- ионов
сильные ¬ Электролиты ® слабые
Мерой силы электролита служит степень Э.Д. ( a )
a = число, распавшихся на ионы молекул
общее число молекул
б)основания—все растворимые, кроме NH 4 OH
в)соли———-все растворимые средние(нормальные)
(Ме+ОН+К.О.)основные ¬ Соли ® средние ( Ме+К.О.)
Определите силу электролитов и назовите вещества
Все соли можно рассматривать как продукты взаимодействия кислоты с основанием, т.е.как продукты реакции нейтрализации. Продуктами взаимодействия каких электролитов будут следующие соли:
сильн. сильн. сильн. слаб. слаб. сильн. слаб. слаб.
первичное восприятие и усвоение нового материала
- выяснить какие соли взаимодействуют с водой, т.е. подвергаются гидролизу
- научиться определять среду растворов солей
- научиться составлять уравнения реакций гидролиза
Работа на доске: составление уравнений реакций гидролиза
KCl + HOH ® KOH + HCl Эта соль гидролизу не подвергается. Как вы думаете почему?
C м. определение гидролизу. Не образуется слабый электролит.
K + + Cl — + HOH ® K + + OH — + H + + Cl — C ократим одинаковые ионы в правой и левой части уравнения и получим:
HOH ® OH — + H + , а вода как известно неэлектролит и следовательно на ионы не диссоциирует, рн=7 среда раствора нейтральная.
ВЫВОД: соль, образованная сильным основанием и сильной кислотой гидролизу не подвергается
При написании уравнений гидролиза следует помнить: то что сильное образуется сразу остальное собираем в соль
Подвергается ли эта соль гидролизу? Почему? См. определение гидролиза.
2K + + CO3 2- + HOH ® K + + OH — + K + + HCO3 —
CO 3 2- + HOH ® OH — + HCO 3 — среда раствора щелочная рн > 7
ВЫВОД: соль, образованная сильным основанием и слабой кислотой гидролизу подвергается. Среда раствора щелочная.(что в соли сильное такая и среда) рн > 7
CuCl2 + HOH ® HCl + CuOHCl
Подвергается ли эта соль гидролизу? Почему? См. определение гидролиза.
Cu 2+ + 2Cl — ® H + + Cl — + CuOH + + Cl —
Cu 2+ + HOH ® H + + CuOH + среда раствора кислая рн 7
ВЫВОД: соль, образованная слабым основанием и сильной кислотой гидролизу подвергается. Среда раствора кислая.(что в соли сильное такая и среда) рн 7
Соль, образованная слабым основанием и слабой кислотой при гидролизе разлагается водой (см. таблицу растворимости), образуются вещества из которых эта соль получена
Al 2 S 3 + 6 HOH ® 2 Al ( OH )3 ¯ + 3 H 2 S среда раствора зависит от степени диссоциации полученных электролитов, или слабо щелочная или слабо кислая, чаще нейтральная.
ВЫВОД: соль, образованная слабым основанием и слабой кислотой разлагается водой. Среда раствора близкая к нейтральной.(что в соли сильнее такая и среда)
нание собственного опыта.
Практический эксперимент: с помощью универсального индикатора определить среду растворов следующих солей K 3 PO 4 , Fe ( NO 3 )3, AgNO 3 , Na 2 SO 4 , MgS
Записать уравнения гидролиза.Определить какая из предложенных солей гидролизу не подвергается.
3K + + PO4 3- + HOH ® K + + OH — + 2K + + HPO4 2-
PO 4 3- + HOH ® OH — + HPO 4 2- среда раствора щелочная рн > 7
Fe 3+ + 3NO3 — + HOH ® H + + NO3 — + FeOH 2+ + 2NO3 —
Fe 3+ + HOH ® H + + FeOH 2+ среда раствора кислая рн 7
Ag + + NO 3 — + HOH ® H + + NO 3 — + AgOH см. таблицу растворимости AgO Н разлагается в момент образования на Ag 2 O ¯ + H 2 O
Ag + + HOH ® H + + AgOH среда раствора кислая рн 7
Na2SO4 эта соль гидролизу не подвергается , т . к . образованна сильным основанием и сильной кислотой рн=7
MgS + 2HOH ® Mg(OH)2 ¯ + H2S рн » 7
Д/З : Записать уравнения гидролиза следующих солей Na 2 S , KBr , Cr 2 ( CO 3 )3, ZnBr 2
Указать среду растворов.
Тема урока: Особые случаи гидролиза солей
Цель крока: использование знаний и способов действий в комплексе и системе
· рассмотреть гидролиз сульфатов и солей, образованных одноосновными слабыми электролитами
· научиться составлять уравнения ступенчатого гидролиза
· изучить условия необходимые для полного протекания гидролиза
I. Проверка Д/З (взаимопроверка по эталону)
Na2S + HOH ® NaOH + NaHS
Na + + S 2- +HOH ® Na + + OH — +Na + + HS-
S 2- + HOH ® OH — + HS — среда раствора щелочная рн 7 Гидролиз по аниону
KBr – гидролизу не подвергается, т.к. образованна сильным основанием и сильной кислотой
Cr 2 ( CO 3 )3 + 6 HOH ® 2 Cr ( OH )3 + 3 H 2 CO 3 соль,образованная слабым основанием и слабой кислотой разлагается водой, среда раствора нейтральная
ZnBr2 + HOH ® HBr + ZnOHBr
Zn 2+ + 2Br — + HOH ® H + + Br — + ZnOH + +Br —
Zn 2+ + HOH ® H + + ZnOH + среда раствора кислая рн > 7 Гидролиз по катиону
Оцените работу по шкале 4дания из-4х – 5; 3 из 4-х – 4; 2 из 4-х -3; незначительные ошибки -4
II. Повторение основных положений гидролиза:
Дать определение гидролизу.
Гидролиз- взаимодействие соли с водой,приводящее к образованию слабого электролита
Какие электролиты относятся к сильным?
Те, которые полностью диссоциируют на ионы
Что служит мерой силы электролита?
Мерой силы электролита служит степень Э.Д. ( a )
a = число, распавшихся на ионы молекул
общее число молекул
Назовите сильные электролиты кислоты, основания, соли.
в)соли———-все растворимые средние(нормальные)
Какие бывают соли по способу образования? Приведите примеры.
образованные сильным основанием и сильной кислотой (ВаС l 2 ), образованные сильным основанием и слабой кислотой (К2 SiO 3 ), образованные слабым основанием и сильной кислотой ( ZnI 2 ), образованные слабым основанием и слабой кислотой( CaS )
Какие соли подвергаются гидролизу?
Образованные сильным основанием и слабой кислотой , слабым основанием и сильной кислотой, слабым основанием и слабой кислотой
Какие соли гидролизу не подвергаются?
Образованные сильным основанием и сильной кислотой
Какие соли разлагаются водой?
Образованные слабым основанием и слабой кислотой
Как определить среду раствора соли?
По способу образования
Если рн =7 то чем может быть образованна такая соль?
Сильным основанием и сильной кислотой или слабым основанием и слабой кислотой
Если рн 7 то чем может быть образованна такая соль?
Слабым основанием и сильной кислотой
Если рн > 7 то чем может быть образованна такая соль?
Сильным основанием и слабой кислотой
III. Углубление и расширение знаний по теме или особые случаи гидролиза:
1. сульфат + Н2О ® Н2 SO 4 + основная соль (Ме+ОН+К.О.)
2Cu 2+ + 2SO4 2- + 2HOH ® 2H + + SO4 2- + 2CuOH + + SO4 2-
2Cu 2+ + 2HOH ® 2H + + 2CuOH + рн 7
С/р MgSO 4, Al 2 ( SO 4 )3 –3ий уровень сложности. После завершения работы в парах сверяем с эталоном, задаем вопросы.
2. соль, образованная слабым одноосновным электролитом
Предварительная подготовка. Определить основность электролитов, образующих следующие соли
Na 3 PO 4 – одноосновное основание и трехосновная кислота
KF — одноосновное основание и одноосновная кислота
Al ( NO 3 )3— трехосновное основание и одноосновная кислота
CuCl 2 — двухосновное основание и одноосновная кислота
FeSO 4 — двухосновное основание и двухосновная кислота
соль, образованная слабым одноосновным электролитом + Н2О ® слабый электролит на ионы не расписываем
KF + HOH ® KOH + HF
K + +F — + HOH ® K + +OH — + HF
F — + HOH ® OH — + HF
С / р NaNO2, KSN, NH4Cl. После завершения работы в парах сверяем с эталоном, задаем вопросы
3. ступенчатый гидролиз присущь солям, образованным многоосновными
кислотами или многоосновными основаниями
Учимся составлять уравнения ступенчатого гидролиза.
I ступень AlCl3 + HOH ® HCl + AlOHCl2
Al 3+ + 3C l- + HOH ® H + + Cl — + AlOH 2+ + 2Cl —
Al 3+ + HOH ® H + + AlOH 2+ рн -?
II ступень AlOHCl2 + HOH ® HCl + Al(OH)2Cl
AlOH 2+ + 2Cl — + HOH ® H + + Cl — + Al(OH)2 + + Cl —
III ступень Al(OH)2Cl + HOH ® HCl + Al(OH)3 ¯
Al(OH)2 + + Cl — + HOH ® H + + Cl — +Al(OH)3
Для протекания гидролиза по второй и третьей ступеням необходимы дополнительные условия( t , ¯ C )
С/р на доске составить уравнения ступенчатого гидролиза Na 2 CO 3, K 3 PO 4 .
Д/З : Записать уравнения гидролиза следующих солей K 2 S (2ступени), ZnSO 4 , KSCN
Указать среду растворов.
Пактическое занятие по теме Гидролиз солей.
Цели урока : совершенствование умений в составлении уравнений гидролиза,
углубление знаний по теме.
· отработать навыки составления уравнений гидролиза солей;
· изучить условия взаимоусиливающего гидролиза;
· научиться составлять уравнения реакций взаимоусиливающего гидролиза;
· рассмотреть гидролиз веществ других классов.
I . Проверка Д/З самопроверка по эталону
K2S + HOH ® KOH + KHS
2K+ + S 2- + HOH ® K + + OH — + K + + HS —
S 2- + HOH ® OH — + HS — рн > 7
KHS + HOH ® KOH + H2S
K + + HS — + HOH ® K + + OH — + H2S
HS — + HOH ® OH — + H2S рн > 7
2Zn 2+ + 2SO4 2- + 2HOH ® 2H + + SO4 2- + 2ZnOH + + SO4 2-
2Zn2+ + 2HOH ® 2H+ + 2ZnOH+ рн 7
KSCN + HOH ® KOH + HSCN
K + + SCN — + HOH ® K + + OH — + HSCN
SCN — + HOH ® OH — + HSCN рн 7
II. Взаимоусиливающий гидролиз – это гидролиз солей разных по способу образования, одновременно присутствующих в растворе.
Н/Р: что произой дет при сливании солей K 2 СО3 и CuCl 2 ?
Так как одна из солей, образованна сильным основанием и слабой кислотой, а другая слабым основанием и сильной кислотой, то они усиливают гидролиз друг друга и он протекает до конца, т.е. сразу по двум ступеням.
Составляем уравнения гидролиза каждой из солей в отдельности, сравниваем с эталоном
2K + + CO3 2- + HOH ® K + + OH — + K + + HCO3 —
CuCl2 + HOH ® HCl + CuOHCl
Cu 2+ + 2Cl — ® H + + Cl — + CuOH + + Cl —
Cu 2+ + HOH ® H + + CuOH +
CuOHCl + HOH ® HCl + Cu(OH)2
CuOH + + Cl — + HOH ® H + + Cl — + Cu(OH)2
CuOH + + HOH ® H + + Cu(OH)2
А теперь записываем суммарное уравнение гидролиза,помня что эти соли усиливают гидролиз друг друга (т.к. они прямопротивоположно различаются по способу образования).
Выполнение упражнений (закрепление)
Что произойдет при сливании растворов следующих солей:
Порядок действий — определяем чем образованны обе соли и будут ли они усиливать
— гидролиз друг друга;
— записываем уравнения всех ступенень гидролиза каждойсоли;
— определяем конечные продукты полного гидролиза:
— составляем суммарное уравнение реакции.
в) Задача на взаимоусиливающмй гидролиз
III. Гидролиз других веществ
Ca 3 P 2 PCl 5 Li 3 N При написании реакций гидролиза бинарных соидинений пользуемся теми же приемами что и для написания реакций гидролиза солей:
определяем чем образованно соединение;
сильное образуется сразу;
валентность элементов до и после реакции одинакова.
Ca 3 P 2 + 6 HOH ® 3 Ca ( OH )2 + 2 PH 3 попробуйте определить среду раствора
IV. Тест. « Оценка усвоения темы»
Из перечисленных солей BaCl 2 , Ca ( NO 3 )2 , ZnSO 4 , NaNO 3 , K 2 SO 3 , AgCl , Li 3 PO 4 , MgS ,
a) соли, которые гидролизу не подвнргаются, их всего? Ответ : 4 (BaCl2, NaNO3, AgCl NaBr)
c) соли, которые при гидролизе разлагаются водой, их всего? Ответ : 3 (MgS, Al2S3, Al2S3)
d) соли, растворы которых имеют щелочную среду раствора, их всего? Ответ :4(K2SO3, Li3PO4, Na2SiO3, KF)
e) соли, растворы которых имеют кислую среду раствора, их всего? Ответ :3 (Ca(NO3)2 , ZnSO4, Al2(SO4)3)
f) соли, растворы которых не изменяют окраску индикаторов, их всего? Ответ : 3 (BaCl2, NaNO3, NaBr)
g) соли, гидролиз которых прортекает по одной ступени, их всего? Ответ : 3 (MgS, KF, (NH4)2CO3)
h) соли, гидролиз которых может протекать по двум ступеням, их всего? Ответ : 4 (Ca(NO3)2 , ZnSO4, K2SO3, Na2SiO3 )
i) соли, гидролиз которых может протекать по трем ступеням, их всего? Ответ : 2 (Li3PO4, Al2(SO4)3)
j) соли, образованные сильным основанием и слабой кислотой, их всего? Ответ : 4 (K2SO3, Li3PO4, Na2SiO3, KF)
k) соли, образованные слабым основанием и сильной кислотой, их всего? Ответ : 3 (Ca(NO3)2 , ZnSO4, Al2(SO4)3)
l) соли, образованные слабым основанием и слабой кислотой, их всего? Ответ : 3 ( MgS, Al2S3, (NH4)2CO3)
o) пары солей, растворы которых будут усиливать гидролиз друг друга, приведите несколько примеров? Ответ :
V. Решение экспериментальных задач.
1. Испытайте растворы солей KI , AlCl 3 , Pb ( NO 3 )2, Na 3 PO 4 универсальсальным индикатором и подтвердите результаты испытаний уравнениями реакций.
2. В трех пронумерованных пробирках находятся растворы солей: ZnCl 2 , Na 2 CO 3 , K 2 SO 4 не используя никаких реактивов кроме универсального индикатора рас познайте содержимое каждой из пробирок. Поясните результаты испытаний.
3. Опишите какие процессы будут происходить при сливании растворов солей: хлорида алюминия и карбоната калия? 3запишите соответствуущее уравнение реакции.
Краткое описание документа:
Тема урока: Гидролиз- взаимодействие соли с водой,приводящее к образованию слабого электролита Гидро- вода, лиз- разлагать. Сравните- электролиз, пиролиз… Цель урока: первичное восприятие и усвоение нового материала Задачи урока: выяснить какие соли взаимодействуют с водой, т.е. подвергаются гидролизу научиться определять среду растворов солей научиться составлять уравнения реакций гидролиза Работа на доске: составление уравнений реакций гидролиза KCl + HOH® KOH + HCl Эта соль гидролизу не подвергается. Как вы думаете почему? Cм. определение гидролизу. Не образуется слабый электролит. K+ + Cl- + HOH® K+ + OH- + H+ + Cl- Cократим одинаковые ионы в правой и левой части уравнения и получим: HOH® OH- + H+ , а вода как известно неэлектролит и следовательно на ионы не диссоциирует, рн=7 среда раствора нейтральная. ВЫВОД: соль, образованная сильным основанием и сильной кислотой гидролизу не подвергается При написании уравнений гидролиза следует помнить: то что сильное образуется сразу остальное собираем в соль K2CO3 + HOH ® KOH + KHCO3 Подвергается ли эта соль гидролизу? Почему? См. определение гидролиза. 2K+ + CO32- + HOH ® K+ + OH- + K+ + HCO3- CO32- + HOH ® OH- + HCO3- среда раствора щелочная рн>7 ВЫВОД: соль, образованная сильным основанием и слабой кислотой гидролизу подвергается. Среда раствора щелочная.(что в соли сильное такая и среда) рн>7 CuCl2 + HOH ® HCl + CuOHCl Подвергается ли эта соль гидролизу? Почему? См. определение гидролиза. Cu2+ + 2Cl- ® H+ + Cl- + CuOH+ + Cl- Cu2+ + HOH ® H+ + CuOH+ среда раствора кислая рн
Уравнения гидролиза солей
По этой ссылке вы найдёте полный курс лекций по математике:
Растворение веществ в воде часто сопровождается химическим взаимодействием обменного характера. Подобные процессы объединяют под названием гидролиза. Гидролизу подвергаются самые различные виды веществ: соли, углеводы, белки, сложные эфиры, жиры и т. д. Одним из важнейших случаев гидролиза является гидролиз солей. Под ним понимают обменное взаимодействие ионов растворенной соли с водой с образованием слабого электролита.
В результате гидролиза образуются — либо слабое основание, либо слабая кислота, либо то и другое, вследствие чего имеет место смещение равновесия диссоциации воды: Рассмотрим следующие случаи гидролиза солей. Q При растворении соли, образованной катионом сильного основания и анионом сильной кислоты (например, KN03, CsCl, Rb2S04 и др.), равновесие диссоциации воды существенно не смещается, так как ионы такой соли с водой не образуют малодиссоциированных продуктов.
Поэтому, например, в системе: CsCl + НОН СзОН + НС1 или cs+ 4- сг + нон т± сз+ + он» + н+ + сг, нон он
единственным малодиссоциированным соединением является вода. В результате равновесие реакции нацело сдвинуто влево, т. е. гидролиз CsCl практически не происходит, и раствор не содержит заметного избытка ни ионов водорода, ни гидроксид-ионов, т. е. имеет нейтральную реакцию. [2]
Соли, образованные катионами сильных оснований и анионами слабых кислот (СН3СООК, Na2C03, K2S и др.), подвергаются гидролизу. Уравнение гидролиза таких солей на примере ацетата калия можно представить следующим образом: СН3СОК + НОН +± СН3СООН + КОН, СН3СОО» + К+ + НОН т± СН3СООН + К* + ОН» или сн3соо- + нон сн3соон 4- он-. (1) Уравнение показывает, что в данном случае гидролизу подвергается анион соли; реакция сопровождается образованием малодиссоциированной кислоты.
При этом связываются ионы водорода воды и в растворе накапливаются гидроксид-ионы, которые и придают ему щелочную реакцию. [3) Соли, образованные катионами слабых оснований и анионами сильных кислот, также гидролизуются (NH4C1, NH4N03, CuC12 и др.). Например: Гидролизу, в этом случае, подвергается катион соли; результатом реакции является образование малодиссо-циированного гидроксида. При этом связываются гид-роксид-иоиы воды и в растворе накапливаются ионы водорода, которые и придают раствору кислую реакцию.
Следует подчеркнуть, что в процессах, отражаемых уравнениями (1) и (2), вода является более слабым электролитом, чем уксусная кислота и гидроксид аммония. Поэтому равновесие реакций (1) и (2) сильно смещено влево, в результате чего гидролиз таких солей идет лишь в определенной степени. R] Соли, образованные катионами слабых оснований и анионами слабых кислот (CH3COONH4, AI2s3, А1(СН3СОО)3 и др.), наиболее легко подвергаются гидролизу, так как их ионы связывают одновременно в слабые электролиты и Н+ и ОН
, образующиеся при диссоциации.
Образование в результате гидролиза слабой кислоты и слабого гидроксида обеспечивает сдвиг равновесия этого процесса вправо.
Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. При равной их силе она может быть и нейтральной, что имеет место, например, при гидролизе CH3COONH4: Практически приходится чаще всего иметь дело с гидролизом солей, содержащих в своем составе многозарядный ион слабого компонента (основания или кислоты) и однозарядные ионы сильного.
При гидролизе подобных соединений — например К2С03 или Cu(N03)2, образуются, как правило, соответственно кислые и основные соли: или Дальше, до образования свободной слабой кислоты или основания, гидролиз обычно не идет из-за накопления в растворе, соответственно, ионов ОН» или Н»1″. Исключения имеют место, когда основные или кислотные свойства многовалентных ионов выражены крайне слабо или когда процесс гидролиза усиливают специально (например, нагреванием).
В подобных случаях гидролиз идет ступенчато и часто практически до конца: FeCl3 + НОН ?± FeOHCl2 + НС1, (I ступень) FeOHCl2 + НОН £ Fe(OH)2Cl + НС1, (II ступень) Fe(OH)2Cl + НОН Fe(OH)3 I + НС1. (Ill ступень) Кислые соли слабых кислот также подвергаются гидролизу. Однако здесь наряду с гидролизом происходит и диссоциация аниона кислой соли. Так, в растворе гидрокарбоната калия одновременно протекают гидролиз иона НС03
, приводящий к накоплению гидроксид-ионов: НС03- + НОН Н2С03 + ОН» и его диссоциация, в результате которой образуются ионы Н+: НС03″ т± С032″ + Н+.
Таким образом, реакция раствора кислой соли может быть как щелочной (если гидролиз аниона преобладает над его диссоциацией — именно это и происходит в растворе гидрокарбоната), так и кислой (в обратном случае). Количественно процесс гидролиза характеризуется с помощью степени гидролиза h и константы КГ. Степенью гидролиза соли называется отношение числа гидро-лизованных молекул соли к общему числу растворенных молекул соли.
Возможно вам будут полезны данные страницы:
Ее обычно выражают в процентах: число гидролизованных молекул . общее число растворенных молекул В большинстве случаев степень гидролиза солей незначительна. Так, в 1 % -ном растворе ацетата натрия h составляет 0,01 % при 25 °С. Степень гидролиза зависит от природы растворенной соли, ее концентрации и температуры раствора. Выражение для константы гидролиза соли (Кг) получают исходя из процесса гидролиза, константы равновесия и постоянства концентрации молекул воды: МАп + НОН МОН + НАп [МОН][НАп] [МАп][НОН] ‘ К[Н20] =
| Влияние химической природы |
составляющих данную соль ионов на степень и константу гидролиза было уже подробно рассмотрено выше. Ввиду обратимости гидролиза равновесие этого процесса зависит от всех тех факторов, которые влияют на равновесие реакций ионного обмена. Например, оно смещается в сторону разложения исходной соли, если получающиеся продукты (чаще всего в виде основных солей) малорастворимы.
Добавляя к системе избыток одного из образующихся при реакции веществ (обычно кислоты или щелочи), можно, в соответствии с законом действующих масс, сместить равновесие в сторону обратной реакции. Напротив, добавление избытка воды, т. е. разбавление раствора, в соответствии с законом действующих масс, ведет к тому, что гидролиз протекает полнее.
Влияние температуры на степень гидролиза вытекает из принципа JTe Шателье. Процесс гидролиза является эндотермическим (поскольку реакция нейтрализации, являющаяся обратной процессу гидролиза, экзотермич-на). С повышением температуры равновесие смещается в сторону эндотермической реакции, т. е. процесс гидролиза усиливается.
Из изложенного выше вытекают общие правила, касающиеся смещения гидролитического равновесия. Если желательно сместить его в сторону возможно более полного разложения соли, то нужно работать с разбавленными растворами и при высокой температуре. Напротив, чтобы гидролиз протекал как можно меньше, следует работать с концентрированными растворами и «на холо- ду». Вопросы и задачи для самостоятельного решения 1.
Какие ученые разработали теорию электролитической диссоциации? 2. Приведите примеры электролитов, относящихся к различным классам неорганических соединений. 3. Как влияет природа химической связи на диссоциацию веществ в растворах? 4. Изобразите схему диссоциации в воде электролитов, имеющих ионную кристаллическую решетку. 5. Изобразите схему диссоциации в воде полярных молекул электролитов. 6. Какова роль диэлектрической проницаемости растворителя в процессе электролитической диссоциации?
7. Как и почему изменяется степень диссоциации слабых электролитов при изменении концентрации раствора? Приведи примеры веществ, являющихся слабыми электролитами. 8. Каково влияние температуры на процесс электролитической диссоциации? 9. При каких условиях возможно сравнение значений степеней диссоциации слабых электролитов? 10. Каково принципиальное отличие сильных электролитов от слабых? 11. Почему разделение электролитов на сильные и слабые в значительной степени условно? 12. Каковы особенности поведения растворов сильных электролитов?
13. Изобразите схемы процессов диссоциации следующих веществ: а) Н3Р04; б) Си(ОН)2; в) MgS04; г) NaHS03; д) MgOHCl. 14. К какому классу неорганических соединений относят воду? Почему? 15. Рассчитайте концентрации ионов в растворах следующих электролитов: а) К+ в растворе карбоната калия с массовой долей К2С03Ю% (р-1,09 г/мл); б) S042
— в 0,5 М растворе K2S04 • A12(SG4)3. Ответ: 1,58; 2. 16. Концентрация сульфат-ионов в растворе сульфата железа (III) составляет 0,16 моль/л. Сколько граммов этой соли содержится в 1 л раствора? Диссоциация соли полная. Ответ: 20 г.
17. Определите степень диссоциации муравьиной кислоты в растворе с концентрацией 0,01 моль/л, если в 1 мл раствора содержится 6,82 • 1018 растворенных частиц (не-диссоциированных молекул и ионов). Ответ: 13,3%. 18. В 1л 0,01 М раствора уксусной кислоты содержится 6,26 • 1021 ее молекул и ионов. Определите степень диссоциации уксусной кислоты. Ответ: 4 %. 19. Рассчитайте массовую долю (%) раствора муравьиной кислоты (р= 1,0 г/мл), если концентрация ионов водорода в нем составляет 8,4 • 10″3 моль/л. Ответ: 1,55%.
20. Рассчитайте рН раствора, если концентрация ионов водорода равна 4,2 • 10
5 моль/л. Ответ: 4,37. 21. Определите рН раствора, если концентрация ОН» равна 10″4 моль/л. Ответ: рН=10. 22. Определите концентрации ионов Н+ и ОН’в растворах, рН которых равна 5,8; 11,4. Ответ: 1,58 • 10
6 моль/л; 6,33 • 10
9 моль/л; 3,98 • 10
12 моль/л; 0,25 • 10
2 моль/л. 23. Напишите в молекулярной и ионно-молекулярной формах уравнения реакции взаимодействия следующих веществ:
а) K2S + NiS04 — д) Ca(N03)2 + К2С03 — б) K2S03 + НС1 — е) HN03 + Ва(ОН)2 в) AgN03 + KI ж) Fe(N03)2 + Na3P04 — г) Fe(S04)3 + КОН з) H2S04 + RbOH 24 Напишите в сокращенной ионной форме уравнения реакций, представленных следующими схемами: а) KOH + FeCl2— в) НСООК 4- H2S04 — б) СаС03 + НС1 — г) KCN + НС1 25. Что называется гидролизом солей? Почему растворы солей могут иметь кислую, щелочную или нейтральную реакцию среды? 26. Какие соли подвергаются гидролизу частично? Приведите примеры. 27. Какие соли и почему подвергаются гидролизу полностью? Приведите примеры.
28. Какие соли не подвергаются гидролизу? Почему это происходит? Приведите примеры таких солей и докажите справедливость своих суждений, написав соответствующие уравнения реакций. 29. В каких случаях при гидролизе солей образуются: а) кислые соли; б) основные соли? Приведите примеры на каждый случай, написав уравнения реакций. 30. Какие вещества помимо солей подвергаются процессу гидролиза? 31. Какое значение имеет гидролиз: а) в живых организмах; б) в важнейших химических производствах; в) в природе? 32. Что такое степень гидролиза и какие факторы влияют на ее величину?
Привести примеры. 33. Что характеризует константа гидролиза? От каких факторов она зависит? 34. Составьте молекулярные и ионно-молекулярные уравнения реакции гидролиза следующих солей: Са(СН3СОО)2, КС1, K2C03, Ni(N03)2. Укажите окраску индикаторов в их растворах. 35. Укажите, какие из солей подвергаются гидролизу: FeCl3, K2S, SnCl2, AgN03. Составьте молекулярные и ионно-молекулярные уравнения процесса гидролиза.
36. Изменится ли окраска фенолфталеина при добавлении к раствору сульфида натрия? 37. Почему раствор хлорида алюминия при добавлении лакмуса окрашивается в красный цвет? 38. Напишите уравнение реакции гидролиза карбоната рубидия и объясните, как влияет на гидролиз разбавление и нагревание раствора. 39. В одну пробирку поместили раствор карбоната цезия, в другую — раствор хлорида никеля (II). Почему при добавлении фенолфталеина малиновую окраску приобретает только один раствор?
Какой? Составьте уравнения гидролиза этих солей. 40. Закончите уравнения следующих реакций с учетом возможности необратимого гидролиза образуемых солей: а) A12(S04)8 + Na2S + НОН = б) FeCl3 + (NH4)2C03 + НОН = . 41. Составьте уравнения реакций необратимого гидролиза солей А1(СН3СОО)3и Сг2(С03)3. 42. Почему при добавлении воды к концентрированному водному раствору хлорида олова (И) выпадает осадок основной соли, а при добавлении раствора соляной кислоты выпадение осадка не происходит?
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://infourok.ru/material.html?mid=58538
http://natalibrilenova.ru/uravneniya-gidroliza-solej/