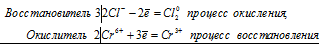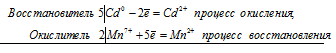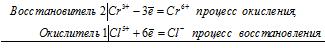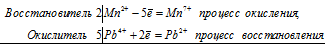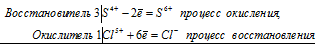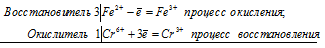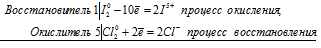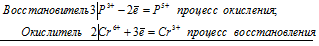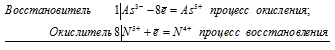Правильное составление электронных уравнений реакций
Решение задач на составлении электронных уравнений химических реакций
Задание 236.
Реакции выражаются схемами:
HCl + CrO3 ⇔ Cl2 + CrCl3 + H2O;
Cd + KMnO4 + H2SO4 ⇔ CdSO4 + MnSO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а) HCl + CrO 3 ⇔ Cl2 + CrCl 3 + H 2 O
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, CrO3 – окислитель; HCl окисляется до Сl2, CrO3 – восстанавливается до CrCl3.
5Сd 0 + 2Mn 7+ = Cd 2+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cd – восстановитель, KMnO 4 – окислитель; Cd окисляется до CdSO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 237.
Реакции выражаются схемами:
Cr2O3 + KClO3 + KOH ⇔ K2CrO4 + KCl + H2O;
MnSO4 + PbO2 + HNO3 ⇔ HMnO4 + Pb(NO3)2 + PbSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + Cl 5+ = 2Cr 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cr2O3 – восстановитель, KClO3 – окислитель; Cr2O3 окисляется до K2CrO4, KClO3 – восстанавливается до KCl.
5Pb 4+ + 2Mn 2+ = 5Pb 2+ + 2Mn 7+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 5 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: PbO2 – восстановитель, MnSO4 – окислитель; PbO2 окисляется до Pb(NO3)2, MnSO4 – восстанавливается до HMnO4.
Задание 238.
Реакции выражаются схемами:
H2SO3 + HClO3 ⇔ H2SO4 + HCl;
FeSO4 + K2Cr2O7 + H2SO4 ⇔ Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H2SO3 – восстановитель, HClO3 – окислитель; H2SO3 окисляется до H2SO4, HClO3 – восстанавливается до HCl.
3Fe 2+ + Cr 6+ = 3Fe 3+ + Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов три. Разделив это число на 3, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 3 на 1 получаем коэффициент 3 для восстановителя и продукта его окисления. Учитывая, что в схеме реакции указаны вещества, содержащие железо и хром с двумя атомами в молекулах Fe2(SO4)3 и Cr2(SO4)3], умножим коэффициенты при окислителе и восстановителе на 2, получим молекулярное уравнение реакции:
Задание 239.
Реакции выражаются схемами:
I2 + Cl2 + H2O ⇔ HClO3 + HCl;
K2Cr2O7 + H3PO3 + H2SO4 ⇔ Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
I 2 0 + 5Cl2 0 ⇔ 2I — + 10Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 10 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: I2 – восстановитель, Cl2 – окислитель; I2 окисляется до HIO3, Cl2 – восстанавливается до HCl.
3P 3+ + 2Cr 6+ = 3P 5+ + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H 3PO 3 – восстановитель, K 2Cr 2O 7 – окислитель; H 3PO 3 окисляется до H 3PO 4, K 2Cr 2O 7 – восстанавливается до Cr 2(SO 4) 3.
Задание 240.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВг; б) K2Cr2O7 и Н3PO3; в) HNO3 и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
АsH3 + НNO3 ⇔ Н3AsO4 + NO2 + Н2O
Решение:
а) Степень окисления в РH3 n(Р) = -3 (низшая), в HBr n(Br) = -1 (низшая). Так как и фосфор, и бром находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в K2Cr2O7 n(Сr) = +6 (высшая); в Н3PO3 n(Р) = +5 (высшая). Так как и хром, и фосфор находятся в своей высшей степени окисления, то оба вещества проявляют только окислительные свойства и взаимодействовать друг с другом не могут;
в) в HNO3 n(N) = +5 (высшая); в H2S n(S) = -2 (низшая). Следовательно, взаимодействие этих веществ возможно, причём HNO3 является окислителем, а H2S – восстановителем.
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
As 3- + 8N 5+ = As 5+ + 8N 4+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 1, получаем коэффициент 8 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Составьте уравнения электронного баланса и на их основании расставьте коэффициенты в уравнениях реакций: а) MnSO4 PbO2 HNO3 HMnO4 Pb(NO3 ) 2 PbSO4 H2O б) NH3 O2 NO H2O
| 🎓 Заказ №: 22178 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Составьте уравнения электронного баланса и на их основании расставьте коэффициенты в уравнениях реакций: а) MnSO4 PbO2 HNO3 HMnO4 Pb(NO3 ) 2 PbSO4 H2O б) NH3 O2 NO H2O
Решение: 237Ш б) N H O N O H2O
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://lfirmal.com/%D0%A1%D0%BE%D1%81%D1%82%D0%B0%D0%B2%D1%8C%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%B1%D0%B0/