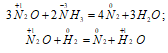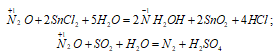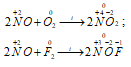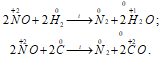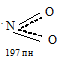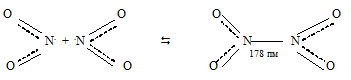Оксид азота IV: получение и химические свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения
1. Оксид азота (IV) образуется при окислении оксида азота (II) кислородом или озоном:
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например , при действии концентрированной азотной кислоты на медь:
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например , при разложении нитрата серебра:
Химические свойства
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
Если растворение NO2 в воде проводить в избытке кислорода , то образуется только азотная кислота:
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
При нагревании выделяется кислород:
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
В присутствии кислорода образуются только нитраты:
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор , уголь , сера , оксид серы (IV) окисляется до оксида серы (VI):
4. Оксид азота (IV) димеризуется :
Строение и свойства оксидов азота
Задача 898.
Описать химические свойства N2О и NO. К какому классу оксидов относятся эти соединения?
Решение:
а) Химические свойства N2O:
1) При нагревании выше 500 0 С оксид азота (I) разлагается на азот и кислород:
2) Оксид азота (I) – сильный окислитель. Реакции N2O с аммиаком и водородом могут сопровождаться взрывом:
В водном растворе N2O взаимодействует с катионом Sn 2+ , восстанавливаясь до NH2OH, а раствор SO2 в воде восстанавливает N2O до N2:
б) Химические свойства NO. В NO атом азота находится в своей промежуточной степени окисления +2, поэтому для него характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей – восстанавливается.
1) NO как восстановитель:
2) NO как окислитель:
3) При взаимодействии NO с щелочными металлами образуется нитроксил-ион NO – , который является электронным аналогом молекулы О2 и имеет кратность связи 2:
NO + Na ↔ Na + + NO –
Нитроксил-ион играет роль промежуточного соединения в обратимых процессах нитрификации. Он димеризуется с образованием гипонитрит-иона:
4) Молекула NO относительно легко теряет электрон, превращаясь в прочный катион нитрозила NO+, изоэлектронный молекулам N2 и СО. Этот катион образует соли нитрозила:
NOF + BF3 ↔ [BF4] –
Тетрафторо-
борат (III) нитрозила
В водных растворах соли нитрозила гидролизуются:
Монооксид азота может быть лигандом в комплексных соединениях. Как лиганд NO называют «нитрозил». Например, [Fe(NO)4] – тетранитрозилжелезо, [Fe(H2O)5NO]Cl2 – хлорид нитрозилпентаакважелеза(II), K2[Fe(NO)(CN)5] – пентацианонитрозилферрат(III).
Оксиды N2O и NO – не солеобразующие сосуды. Они не взаимодействуют с водой, растворами кислот и оснований.
Задача 899.
Что представляет собой бурый газ, выделяющийся при действии концентрированной азотной кислоты на металлы? Из каких молекул он состоит? Почему его окраска усиливается при повышении температуры и ослабляется при ее понижении? Будет ли этот газ подчиняться закону Бойля — Мариотта, если подвергать его сжатию при постоянной температуре? Составить уравнения реакций, происходящих при растворении этого газа в воде и в растворе щелочи.
Решение:
При действии на металлы концентрированной азотной кислотой выделяется оксид азота (IV) NO2 – бурый очень токсичный газ:
Молекула NO2 нелинейная:
Угол ONO равен 134,1 0
Её неспаренный электрон находится на связывающей орбитали. Благодаря этому при повышении давления и понижении температуры NO2 переходит в бесцветный димер:
При температуре от -11,2 0 С до 140 0 С бурый газ состоит из молекул NO2 и N2O4, которые в интервале этих температур находятся в равновесии друг с другом:
При повышении температуры до 140 0 С окраска бурого газа усиливается до почти чёрной. Это объясняется тем, что при нагревании равновесие в системе
N2O4 —2NO2 сместится в сторону образования NO2, т. е. при нагревании идёт диссоциация молекул N2O4 до образования в системе преимущественно молекул NO2, которые и придают тёмно-бурую окраску. Наоборот, при охлаждении в системе N2O4 —2NO2 происходит преимущественно димеризация молекул NO2 с образованием молекул N2O4, что и приводит к ослаблению окраски бурого газа.
Если мы будем повышать температуру системы больше 140 о С, то начнётся диссоциация молекул NO2 на NO и О2 (2NO2 ↔ 2NO + О2) и газ будет обесцвечиваться.
Если же бурый газ подвергнуть сжатию при постоянной температуре, то равновесие в системе N2O4 ↔ 2NO2, согласно принципу Ле Шателье, сместится влево, в сторону уменьшения числа газообразных веществ (в сторону уменьшения объёма в системе). При этом объём системы уменьшится, окраска будет становиться светлее.
Задача 900.
Почему молекула NO2 легко димеризуется, а для SO2 подобный процесс не характерен?
Решение:
Молекула NO2 нелинейная, имеет угловую форму с sp 2 -гибридизацией орбиталей атома азота:
Угол ONO равен 134,1 0
Её неспаренный электрон находится на связывающей орбитали. Благодаря этому при повышении давления и понижении температуры NO2 переходит в бесцветный димер:
угол ONO = 135 0
2ОN . + . NO2 ↔ 2ОN—NO2
Молекула N2O4 плоская. Таким образом, связь между двумя молекулами NO2 происходит за счёт объединения неспаренных электронов атомов азота обеих молекул.
Молекула SO2 имеет также как молекула NO2 угловую форму с sp 2 -гибридизацией орбиталей атома серы:
Угол OSO равна 119,5 0 , длина связи O—S равна 143 пм.
На связывающей орбитали в молекуле SO2 находятся два спаренных электрона, поэтому молекулы не могут димеризоваться.
I. NO — окислитель
NO2 — оксид азота (IV), диоксид азота
При обычной температуре NO2 — красно-бурый ядовитый газ с резким запахом. Представляет собой смесь NO2 и его димера N2O4 в соотношении -1:4. Диоксид азота хорошо растворяется в воде.
Способы получения
I. Промышленный — окисление NO: 2NO + O2 = 2NO2
Химические свойства
NO2 — кислотный оксид, смешанный ангидрид 2-х кислот
NO2 взаимодействует с водой, основными оксидами и щелочами. Но реакции протекают не так, как с обычными оксидами — они всегда окислительно — восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO2 при растворении в воде диспропорционирует с образованием 2-х кислот — азотной и азотистой:
Если растворение происходит в присутствии O2, то образуется одна кислота — азотная:
Аналогичным образом происходит взаимодействие NO2 со щелочами:
NO2 — очень сильный окислитель
По окислительной способности NO2 превосходит азотную кислоту. В его атмосфере горят С, S, Р, металлы и некоторые органические вещества. При этом NO2 восстанавливается до свободного азота:
2NO2 + 8HI = N2 + 4I2 + 4Н2О (возникает фиолетовое пламя)
В присутствии Pt или Ni диоксид азота восстанавливается водородом до аммиака:
Как окислитель NO2 используется в ракетных топливах. При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
N2O3 и N2O5 — неустойчивые вещества
Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-10 0 С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
http://buzani.ru/zadachi/khimiya-glinka/1292-oksidy-azota-zadachi-898-900
http://examchemistry.com/content/lesson/neorgveshestva/oksyduazota.html