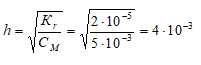Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN, б) Na2CO3
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN, б) Na2CO3. в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение.а) Цианид калия KCN — соль слабой одноосновной кислоты HCN и сильного основания КОН. При растворении в воде, молекулы KCN полностью диссоциируют на катионы K + и анионы CN — . Катионы К + не могут связывать ионы ОН — воды, так как КОН — сильный электролит. Анионы же CN — связывают ионы Н + воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
CN — + Н2О ↔ НCN + ОН —
или в молекулярной форме
КCN + Н2О ↔ НCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН — , поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO3 2- , связывая водородные ионы воды, образуют анионы кислой соли НСО3 — , а не молекулы Н2СОз, так как ионы НСО3 — диссоциируют гораздо труднее, чем молекулы Н2СОз. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
или в молекулярной форме
В растворе появляется избыток ионов ОН — , поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSО4 — соль слабого многокислотного основания Zn(OH)2
и сильной кислоты H2SО4. В этом случае катионы Zn +2 связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образование молекул Zn(OH)2 нe происходит, так как ионы ZnOH + диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn +2 + Н2О ↔ ZnOH + + Н +
или в молекулярной форме
В растворе появляется избыток ионов водорода, поэтому раствор ZnSО4 имеет кислую реакцию (рН
Гидролиз цианида калия
KCN — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Молекулярное уравнение
KCN + HOH ⇄ HCN + KOH
Полное ионное уравнение
K + + CN — + HOH ⇄ HCN + K + + OH —
Сокращенное (краткое) ионное уравнение
CN — + HOH ⇄ HCN + OH —
Среда и pH раствора цианида калия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
http://chemer.ru/services/hydrolysis/salts/KCN
http://buzani.ru/zadachi/obshchaya-khimiya/1413-gidrokarbonat-natriya-zadachi-15-16