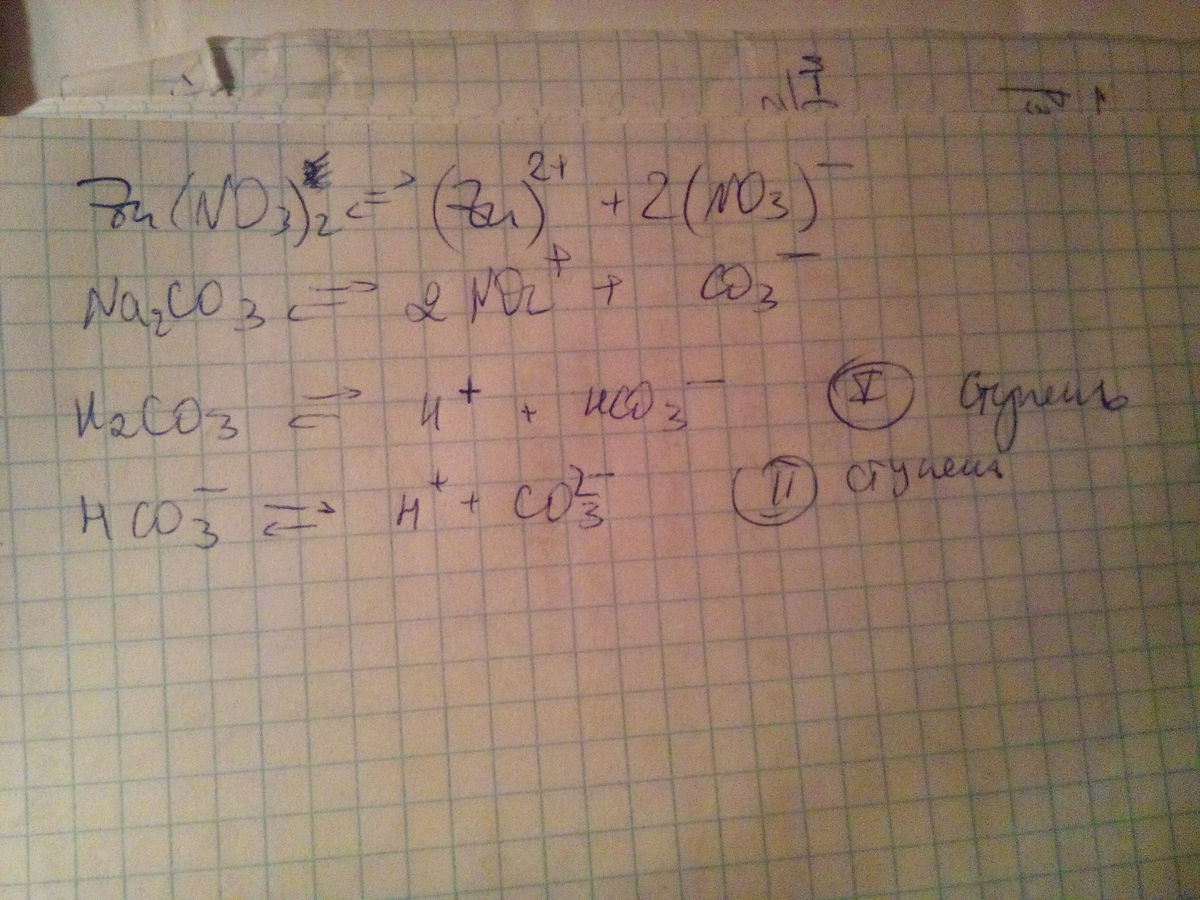Составьте уравнения диссоциации следующих электролитов : нитрата цинка, карбоната натрия , угольной кислоты?
Химия | 5 — 9 классы
Составьте уравнения диссоциации следующих электролитов : нитрата цинка, карбоната натрия , угольной кислоты.
Кислота диссоциирует двуступенчато
Соли диссоциируют ступенчато, только если они являются основными или кислотными.
Написать уравнения реакций диссоциации следующих веществ : нитрат натрия, карбонат калия, гидроксид железа (III), сульфат алюминия ; хлорид бария, оксид цинка, фосфат калия, серная кислота, гидроксид ?
Написать уравнения реакций диссоциации следующих веществ : нитрат натрия, карбонат калия, гидроксид железа (III), сульфат алюминия ; хлорид бария, оксид цинка, фосфат калия, серная кислота, гидроксид бария.
Напишите формулы и определите силу электролитов :а?
Напишите формулы и определите силу электролитов :
Написать уравнения диссоциации веществ : карбоната калия, гидроксида кальция, фосфата аммония, бромоводородной кислоты, угольной кислоты, силиката натрия, сульфита натрия?
Написать уравнения диссоциации веществ : карбоната калия, гидроксида кальция, фосфата аммония, бромоводородной кислоты, угольной кислоты, силиката натрия, сульфита натрия.
Составьте уравнения диссоциации следующих электролитов : иодид бария, серная кислота, гидроксид кальция?
Составьте уравнения диссоциации следующих электролитов : иодид бария, серная кислота, гидроксид кальция.
Напишите уравнения электралитической диссоциации веществ гидроксид натрия карбонат натрия сероводародная кислота гидроксид бария нитрат свинца?
Напишите уравнения электралитической диссоциации веществ гидроксид натрия карбонат натрия сероводародная кислота гидроксид бария нитрат свинца.
Составьте формулы следующих солей : нитрата бария, хлорида алюминия?
Составьте формулы следующих солей : нитрата бария, хлорида алюминия.
Карбоната натрия, фосфата калия.
Напишите уравнения диссоциации этих солей.
СРОЧНО ПОМОГИТЕ С ХИМИЕЙ?
СРОЧНО ПОМОГИТЕ С ХИМИЕЙ!
Запишите уравнения диссоциации следующих электролитов : карбоната натрия, нитрата железа (3), гидроксид бария, азотной кислоты.
Срочно помогите с химией?
Срочно помогите с химией!
Запишите уравнения диссоциации следующих электролитов : карбоната натрия, нитрата железа(3), гидроксида бария, азотная кислоты.
Из данного перечня выберите сильные электролиты :А) уксусная кислота ;Б) нитрат натрия ;В) нитрат бария ;Г) сероводородная кислота ;Д) гидроксид бария ;Е) сульфид натрия ;Ж) угольная кислота ;З) карбо?
Из данного перечня выберите сильные электролиты :
А) уксусная кислота ;
Б) нитрат натрия ;
Г) сероводородная кислота ;
Д) гидроксид бария ;
Е) сульфид натрия ;
Ж) угольная кислота ;
З) карбонат калия.
Напишите уравнения электролитической диссоциации следующих веществ хлорида магния карбоната калия нитрат железа III гидроксид натрия азотная кислота?
Напишите уравнения электролитической диссоциации следующих веществ хлорида магния карбоната калия нитрат железа III гидроксид натрия азотная кислота.
На странице вопроса Составьте уравнения диссоциации следующих электролитов : нитрата цинка, карбоната натрия , угольной кислоты? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
№1 ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона Ионная связь — случай поляризации ковалентной полярной связи (металл + неметалл) Валентность — способность атомов химических элементов образовывать определённое число химических связ..
S + O2 — > SO2 S(0) — 4e — > S( + 4) 1 ок — ие в — ль O2(0) + 4e — > 2O( — 2) 1 в — ие ок — ль 2SO2 + O2 — > 2SO3 SO3 + H2O — > H2SO4 H2SO4 + 2NaOH — > Na2SO4 + 2H2O.
4 — незнаю точно наверное 1 или 2 5 — г 6 — 7 — б 1500 градусов 8 — г 9 — г.
1) Дано : m(Li) = 22 н Найти : m(LiOH) Решение : 2Li + 2H2O = 2LiOH + H2 газ n(Li) = m / M M(Li) = 7 г / моль n(Li) = 22 / 7 = 3 моль По уравнению реакции : n(Li) = n(LiOH) = 3 моль m(LiOH) = n•M M(LiOH) = 7 + 16 + 1 = 24 г / моль m(LiOH) = 24•3 = 72..
2Ca + O₂ = 2CaO Ca⁰ — 2e = Ca⁺² 4 2 кальций восстановитель, процесс окисления O₂ + 4e = 2O⁻² 2 1 кислород окислитель, процесс восстановления H₂ + Cl₂ = 2HCl H₂⁰ — 2e = 2H⁺¹ 2 1 водород восстановитель, процесс окисления Cl₂⁰ + 2e = 2Cl⁻¹ 2 1 хлор окис..
Вообщем так получается . На железо вверху не смотри, это к другому))).
Никакое. O2, H2 — ковалентная неполярная CaCl2 — ионная Ba — металлическая.
Напишите уравнения электролитической диссоциации: а) нитрата меди(ii); б) соляной кислоты; в) сульфата алюминия; г) гидроксида бария; д) сульфата цинка
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,297
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,223
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Соли цинка
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
http://www.soloby.ru/469099/%D0%BD%D0%B0%D0%BF%D0%B8%D1%88%D0%B8%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9-%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D0%B8-%D0%B3%D0%B8%D0%B4%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4%D0%B0
http://chemege.ru/soli-zink/