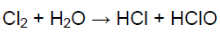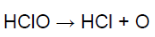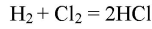Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e016bcd8ab97a40 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Вопрос № 6 Охарактеризуйте химические свойств хлора . Составьте уравнения химических реакций, показывающие: а ) взаимодействие лития с хлором; б) сгорание порошка железа в хлоре; в) горение водорода в хлоре; г) взаимодействие хлора с водой. Проставьте ст
Вопрос № 6 Охарактеризуйте химические свойств хлора. Составьте уравнения химических реакций, показывающие:
а) взаимодействие лития с хлором;
б) сгорание порошка железа в хлоре;
в) горение водорода в хлоре;
г) взаимодействие хлора с водой. Проставьте степени окисления над химическими знаками. Поясните, что в этих реакциях окисляется и что восстанавливается.
1) хлор реагирует с простыми веществами, выступая в качестве окислителя:
2) хлор реагирует с водой; в этой реакции хлор является окислителем и восстановителем одновременно:
3) хлор реагирует с щелочами; в этих реакциях хлор так же является окислителем и восстановителем одновременно:
4) хлор вытесняет из солей бром и иод; в этих реакциях хлор является окислителем:

задача №6
к главе «Глава IX. Галогены Задачи к §§ 46, 47 (стр. 145) ».
Вопросы к параграфу 13 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
§ 13. Хлор
Вопросы и задания
1. В виде каких соединений хлор встречается в природе? Назовите наиболее важные из них и покажите их месторождения на карте. Почему хлор в природе не встречается в свободном состоянии? Оцените выполнение этого задания у соседа по парте.
Из-за высокой активности хлор в природе встречается только в виде соединений в составе минералов: галита NaCl (Северная Америка), сильвина KCl (Германия, Великобритания, Канада, США, Индия, Италия, Россия, Белоруссия), сильвинита KCL•NaCl (Канада, Россия, Белоруссия, Израиль, Узбекистан, Германия), бишофита MgCL2•6H2O (Германия, Россия, Украина), карналлита KCl•MgCl2•6H2O, каинита KCl•MgSO4•3H2O.
2. Охарактеризуйте основные химические свойства хлора. Составьте уравнения химических реакций: а) лития с хлором; б) сгорания порошка железа в хлоре; в) горения водорода в хлоре; г) взаимодействия хлора с водой. Над знаками химических элементов проставьте степени окисления. Укажите окислитель и восстановитель.
3. Почему синяя лакмусовая бумага в свежеприготовленной хлорной воде обесцвечивается, а в хлорной воде, которая длительное время находилась на свету, краснеет?
Постепенно образовывается соляная кислота, которая создаёт кислую среду раствора и окрашивает лакмус в красный цвет. В свежеприготовленном растворе хлор не успевает среагировать, потому что вода является нейтральной средой, лакмус обесцвечивается.
4. На каких химических свойствах хлора основано его использование на практике? Напишите уравнения соответствующих реакций.
1.В хозяйственной деятельности: отбеливание тканей, очищение питьевой воды:
При взаимодействии хлора с водой образуется хлорноватистая кислота (сильный окислитель). Она разлагается, образуя кислород, обеспечивающий отбеливание.
2.Хлорирование (Получение пластмасс, медикаментов, красителей путём присоединения атомов хлора к органическим соединениям).
3.Производство соляной кислоты:
5. В закрытом прочном сосуде смешали 8 л хлора с 12 л водорода (н. у.) и смесь взорвали. Какой объём хлороводорода получился? Какой газ и в каком объёме остался в избытке?
6. Рассчитайте объем (н. у.), массу и количество вещества хлора, выделившеюся при взаимодействии оксида марганца(IV) МnO2 массой 17,4 г с соляной кислотой, взятой в избытке.
7. Рассмотрите рисунок 11. Используя Интернет или дополнительную литературу, узнайте, какое применение находят хлориды свинца и титана.
Хлорид титана (IV) TiCl4 применяется для:
- Как дымообразователь, для получения титана, оксида TiO2, катализаторов.
- Производства пигментной двуокиси титана, губчатого титана.
Хлорид свинца (II) PbCl2 применяется:
- Как катализатор в химической промышленности.
- Как катодный материал в резервных источниках тока.
http://5terka.com/node/1341
http://gdzwow.com/answers/9-himiya-uch-rudzitis-vopr-k-par-13.html