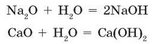Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6defefdcd8d74c50 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Вода соединяется с кислотными оксидами, образуя кислоты, например: Н2О + СО2 = Н2СО3. Составьте уравнения реакций воды с
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Взаимодействие воды с оксидами
Понятие о кислотах и основаниях
Многие оксиды способны вступать в химические реакции с водой. Обычно эти реакции являются реакциями соединения, в результате которых образуются продукты присоединения воды к оксидам. Вещества, образующиеся путем соединения воды с другими веществами, называют гидратами.
В зависимости от того, с каким оксидом взаимодействует вода, может образоваться два типа гидратов: кислоты и основания. Кислоты состоят из атомов Гидрогена и кислотного остатка (H2SO4, ^ТОд), а в формулах оснований на первое место записывают металлический элемент, с которым соединяется гидроксильная группа — ОН (KOH, Ba(OH)2). В зависимости от гидрата, соответствующему определенному оксиду, среди оксидов выделяют две группы: кислотные оксиды. и основные оксиды.
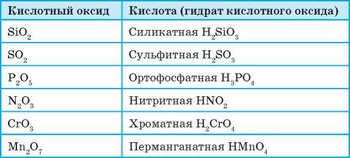
Все кислотные оксиды, за исключением силиций(^) оксида SiО2, в обычных условиях вступают в реакции соединения с водой с образованием кислот:
Оксиды, гидраты которых являются кислотами, называют кислотными оксидами.
Большинство кислотных оксидов — это оксиды неметаллических элементов. Но кислотные оксиды могут образовывать и металлические элементы, если эти элементы могут проявлять высокие валентности, выше четырех. Так, к кислотным оксидам относится хром(У1) оксид Сг03 и манган(УП) оксид Мп207.
Формулы наиболее употребляемых кислотных оксидов и соответствующих им кислот приведены в таблице 5.
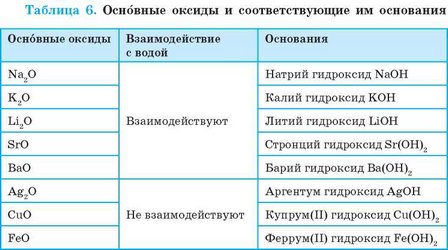
Продукты реакции оксидов с водой (гидраты) могут проявлять основные свойства. Если гидрат оксида является основанием, то такой оксид — основный.
Оксиды, гидраты которых являются основаниями, называют основными оксидами.
К основным оксидам относятся оксиды металлических элементов. Это, как правило, оксиды одно-, дву-, а иногда трехвалентных металлических элементов (табл. 6).
Большинство основных оксидов с водой не взаимодействуют. В реакцию с водой вступают лишь оксиды, гидраты которых растворяются в воде (см. табл. 6, с. 161). Такие гидраты называют щелочами:
• Единственный кислотный оксид, который в обычных условиях не взаимодействует с водой,— это силиций(1У) оксид SiO2, которому соответствует силикатная кислота H2SiO3. Он широко распространен в природе в составе минерала кварца. Обычный кварцевый песок на берегах морей и рек — это и есть силиций(1У) оксид.
• При взаимодействии кальций оксида (негашеной извести) с водой образуется кальций гидроксид (гашеная известь). Во время этой реакции выделяется так много теплоты, что вода может закипеть. Эту реакцию используют в так называемых химических грелках для разогревания завтраков или напитков в одноразовых пакетах.
Выявление кислот и оснований в растворах
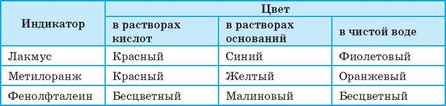
Большинство оксидов и соответствующих им гидратов — бесцветные соединения, поэтому выявить их наличие или различить кислоты и основания без «посторонней помощи» невозможно. Для выявления кислот и оснований в растворах используют индикаторы — сложные органические соединения, которые изменяют свою окраску в зависимости от наличия кислоты или основания в растворе (рис. 114). Наиболее употребляемые индикаторы и их цвет при наличии кислот и оснований приведены в таблице 7.
Таблица 7. Цвет некоторых индикаторов при наличии кислот, оснований и в воде
Чаще всего индикаторы используют в виде растворов — в воде или спирте. Удобнее использовать индикаторную бумагу — обычную бумагу, пропитанную раствором индикатора (рис. 115).
ЛАБОРАТОРНЫЙ ОПЫТ № 5
Испытание водных растворов кислот и щелочей индикаторами
Оборудование: штатив с пробирками.
Реактивы: растворы основания, кислоты, вода, метилоранж, фенолфталеин, лакмус.
• для опытов используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза.
1. Подготовьте по три пробирки с водой, раствором кислоты и раствором основания.
2. В первую пробирку с водой добавьте несколько капель раствора метилоранжа, во вторую — лакмуса, в третью — фенолфталеина.
3. Добавьте индикаторы к растворам кислоты и основания.
4. Сравните цвет индикаторов в разных пробирках. Запишите результаты в тетрадь.
1. Оксиды способны соединяться с водой с образованием гидратов. Гидраты кислотных оксидов — кислоты, а основных — основания.
2. К кислотным оксидам относятся оксиды неметаллических элементов и оксиды металлических элементов с валентностью выше IV. К основным оксидам относятся оксиды металлических элементов с валентностью I, II и иногда 111.
3. Для выявления кислот и оснований в растворе используют индикаторы — вещества, цвет которых изменяется при наличии кислоты или основания.
1. Какие оксиды называют кислотными, а какие — основными?
2. Какие вещества называют гидратами?
3. Какие оксиды (кислотные и основные) в обычных условиях взаимодействуют с водой, а какие — нет?
Задания для усвоения материала
1. Приведите уравнения реакций кислотных и основных оксидов с водой.
2. Из приведенного перечня выпишите отдельно формулы оксидов: а) кислотных; б) основных. №20, Р205, С02, SO3, СгО, Си20, SiО2, Мп207.
3. Какие из приведенных оксидов взаимодействуют с водой? Составьте соответствующие уравнения реакций. №20, С02, SO3, СгО, SiО2.
4. Раствор, который образовался при растворении газообразного оксида в воде, окрашивает лакмус в красный цвет. Какой это газ мог бы быть? Составьте уравнения реакций.
5. Гашение извести — это взаимодействие негашеной извести (кальций оксида) с водой. Составьте уравнение этой реакции.
6. Как вы считаете, существуют ли в природных условиях фосфор(У) оксид, сульфур(У1) оксид и натрий оксид? Ответ обоснуйте.
7. Дополните схемы реакций и назовите продукты реакции:
8*. Некоторые оксиды используют как осушители для обезвоживания газов. На каком принципе основано действие оксидов как осушителей? Какие оксиды можно для этого использовать и почему?
http://www.soloby.ru/822413/%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D1%8F%D0%B5%D1%82%D1%81%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%BD%D1%8B%D0%BC%D0%B8-%D0%BE%D0%BA%D1%81%D0%B8%D0%B4%D0%B0%D0%BC%D0%B8-%D0%BD%D0%B0%D0%BF%D1%80%D0%B8%D0%BC%D0%B5%D1%80-%D1%81%D0%BE%D1%81%D1%82%D0%B0%D0%B2%D1%8C%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F
http://narodna-osvita.com.ua/6680-vzaimodeystvie-vody-s-oksidami.html