Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Составьте уравнение реакции гидролиза этилацетата ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ для студентов биолого-почвенного факультета Работа № 2 Задания к работе 1. Изучить кинетику реакции гидролиза этилацетата методом отбора проб при двух температурах. 2. Определить графическим и аналитическим методами среднюю константу скорости реакции при каждой температуре. 3. Рассчитать температурный коэффициент константы скорости и энергию активации реакции. Гидролиз этилацетата протекает следующим образом: СН3СООС2Н5 + Н2О В нашем случае реакция проводится в присутствии соляной кислоты, что значительно увеличивает скорость реакции. По мере протекания реакции гидролиза концентрация ионов водорода в реакционной смеси увеличивается; скорость реакции определяют, оттитровывая пробы через некоторые промежутки времени. В две пронумерованные чистые сухие колбы емкостью 100 мл наливают по 50 мл 0.2 M раствора соляной кислоты; колбы помещают в термостаты с указанной преподавателем температурой (например, колба № 1 — 25 °С, колба № 2 — 30 °С). После того, как растворы примут температуру термостата (через 10-15 минут), к ним приливают по 5 мл этилацетата и, перемешав содержимое колбы, немедленно отбирают пипеткой пробу объемом 2 мл. Момент отбора первой пробы считают началом реакции. Добавление этилацетата в колбу № 2 производят через 5-10 минут после начала реакции в колбе № 1. Взятую пробу выливают в колбу с 40 — 50 мл предварительно охлажденной дистиллированной воды (t от 0 до 2 °С) для торможения реакции и титруют 0.05 н. раствором NаОН с фенолфталеином до появления устойчивого слабо-розового окрашивания. Следующие пробы отбирают через 15, 30, 45, 60 и 75 минут после начала реакции. Титрование первой пробы позволяет определить концентрацию соляной кислоты в реакционной смеси. Для определения исходной концентрации этилацетата необходимо оттитровать пробу, взятую после окончания реакции. Для ускорения реакции гидролиза эфира одну из колб после отбора последней пробы нагревают с обратным холодильником на водяной бане при температуре 70 — 80 °С в течении 30 минут и, охладив раствор, титруют пробу объемом 2 мл. Константы скорости для каждого момента времени вычисляют по формуле (1) и затем находят среднее значение: Здесь t — время от начала реакции, мин; Аналогичные вычисления производят для каждой температуры. Полученные результаты заносят в таблицу 1. Щелочной гидролиз этилацетата — реакция второго порядка с константой скорости k = 0,084 л/(моль*с). Взят 1 л 0,05 М раствора этилацетата. Какое время понадобится Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы. Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня! Описание и исходные данные задания, 50% решения + фотография:Щелочной гидролиз этилацетата — реакция второго порядка с константой скорости k = 0,084 л/(моль*с). Взят 1 л 0,05 М раствора этилацетата. Какое время понадобится для образования 1,15 г этанола при исходной концентрации щелочи: а) 0,05 М; б) 0,1 М ? Решение: количество образованного этанола: n ( C 2 H 5 OH ) = m ( C 2 H 5 OH )/ M ( C 2 H 5 OH ) = 1,15/46 = 0,025 моль то есть концентрация эфира и щелочи уменьшится на 0,025 моль/л а) рассчитаем конечные концентрации щелочи и эфира: С( CH 3 COOC 2 H 5 ) = С( KOH ) = 0,05-0,025 = 0,025 моль/л
Присылайте задания в любое время дня и ночи в ➔ Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института. Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды. Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги. источники: http://physchem.chimfak.sfedu.ru/Source/PCC_lab/pcclab_2.html http://natalibrilenova.ru/schelochnoj-gidroliz-etilatsetata-reaktsiya-vtorogo-poryadka-s-konstantoj-skorosti-k—0084-lmols-vzyat-1-l-005-m-rastvora-etilatsetata-kakoe-vremya-ponadobitsya/ |


 С2Н5ОН + СН3СООН
С2Н5ОН + СН3СООН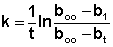 (1)
(1) Готовое решение: Заказ №8423
Готовое решение: Заказ №8423 Тип работы: Задача
Тип работы: Задача Статус: Выполнен (Зачтена преподавателем ВУЗа)
Статус: Выполнен (Зачтена преподавателем ВУЗа) Предмет: Химия
Предмет: Химия Дата выполнения: 05.09.2020
Дата выполнения: 05.09.2020 Цена: 209 руб.
Цена: 209 руб.

