Составьте уравнения реакций по следующим
данным:
1)
При окислении алюминия кислородом образуется
оксид
2)
При взаимодействии меди с кислородом образовался
оксид меди(II)
3)
При горении этилена (С2Н4)
образуется углекислый газ и вода.
4)
Бензол (С6Н6) сожгли в
кислороде. Получили углекислый газ.
5)
Из железа получили оксид железа (III)
6)
Уголь сожжен на
воздухе.
7)
Кислород можно получить при разложении
перекиси водорода (Н2О2).
8)
При сжигании серы получили оксид серы (IV)
9)
Пирит (FeS2) подвергли обжигу. При этом образовался оксид железа (III) и оксид серы (IV)
Составьте уравнение реакции по следующим данным при взаимодействии
1.3 РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ “ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕРМОХИМИЯ”
(для нехимических специальностей)
1. Рассчита й те Δ H o 298 химическо й реак ц ии Na2O(т) + H2O(ж) → 2NaOH(т)
по значениям стандартных теплот образования веществ (
По данным таблицы 1 приложения, стандартные энтальпии образования Na2O(т), H2O(ж) и NaOH (т) при 298К равны соответственно –416, –286 и –427,8 кДж/моль. Используя следствие из закона Гесса, рассчитываем Δ H o 298 химическо й реак ц ии :
Δ H o 298 = 2


– [–416 + (–286)] = –153,6 кДж.
2. Определите, как изменяется энтропия при протекании химического процесса Na2O(т) + H2O(ж) → 2NaOH(т).
В данном процессе при взаимодействии 1 моль кристаллического и 1 моль жидкого вещества образуется 2 моль кристаллического вещества. Следовательно, система переходит в состояние с меньшим беспорядком, и энтропия уменьшается ( Δ S 0).
3. Рассчита й те величину Δ S o 298 для про ц есса
Na2O(т) + H2O(ж) → 2NaOH(т), используя значения стандартных энтропи й веществ (см. таблицу 1 приложения).
Используя справочные данные: S o ( NaOH,т ) = 64,16 Дж/(моль · К),
S o (Na2O,т) = 75,5 Дж/(моль · К), S o (H2O,ж) = 70 Дж/(моль · К), рассчитываем Δ S o 298 :
Δ S o 298 = 2 · S o ( NaOH , т ) – [ S o (Na2O, т ) + S o (H2O, ж )] = 2 · 64,16 – (75,5 + 70) =
= – 17,18 Дж / К .
4. Рассчита й те изменение энергии Гиббса ( Δ G o 298 ) для про ц есса
Na2O(т) + H2O(ж) → 2NaOH(т) по значениям стандартных энергий Гиббса образования веществ (см. таблицу 1 приложения). Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298К ?
При стандартных условиях и T=298К Δ G o 298 можно рассчитать как разность суммарной энергии Гиббса образования продуктов реакции и суммарной энергии Гиббса образования исходных веществ. Необходимые справочные данные: 


Δ G o 298 = 2 · 


– [–378 + (–237)] = –147,2 кДж.
Значение Δ G o 298 отрицательно, поэтому самопроизвольное протекание реакции возможно.
Ответ: –147,2 кДж; возможно.
5. Определите, возможно ли при 95 o С самопроизвольное протекание про ц есса Na2O(т) + H2O(ж) → 2NaOH(т). Ответ обосну й те, рассчитав величину изменения энергии Гиббса при данно й температуре.
Переведем температуру в шкалу Кельвина: Т=273+95=368К. Для расчета Δ G o 368 воспользуемся уравнением:
Воспользуемся изменениями энтальпии и энтропии, рассчитанными для данного процесса в предыдущих задачах. При этом величину изменения энтропии необходимо перевести из Дж /К в кДж/К, поскольку значения Δ H и Δ G обычно измеряют в кДж.
–17,18 Дж /К = –0,01718 кДж/К
Δ G o 368 = –153,6 – 368 · (–0,01718) = –147,3 кДж.
Таким образом, Δ G o 368 o С возможно.
Ответ: –147,3 кДж; возможно.
6. Составьте термохимическое уравнение реакции взаимодействия Na2O(т) и H2O(ж), если при этом образуется 1 моль NaOH (т). В ответе приведите количество теплоты, указанное в термохимическом уравнении.
Коэффициенты в термохимическом уравнении имеют смысл молей. Поэтому допустимы дробные значения коэффициентов. 1 моль гидроксида натрия может образоваться из 1/2 моля оксида натрия и 1/2 моля воды. В задании 1 (см. выше) рассчитано, что при образовании 2 моль NaOH в данной реакции выделяется 153,6 кДж теплоты ( Δ H o 298 = –153,6 кДж). Поэтому при образовании 1 моль NaOH количество выделившейся теплоты будет в 2 раза меньше, т.е. 76,8 кДж. В термохимическом уравнении количество выделяющейся теплоты указывают со знаком “плюс”: 1/2 Na2O(т) + 1/2 H2O(ж) → NaOH (т) + 76,8 кДж.
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
- Оглавление
- Занятия
- Обсуждение
- О курсе
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Соотношение количеств веществ, участвующих в реакции
Коэффициенты в уравнении реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2H2 + O2 = 2H2O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
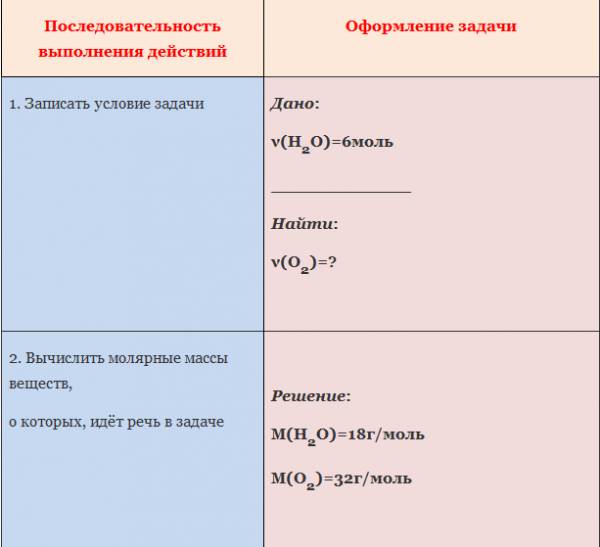
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.
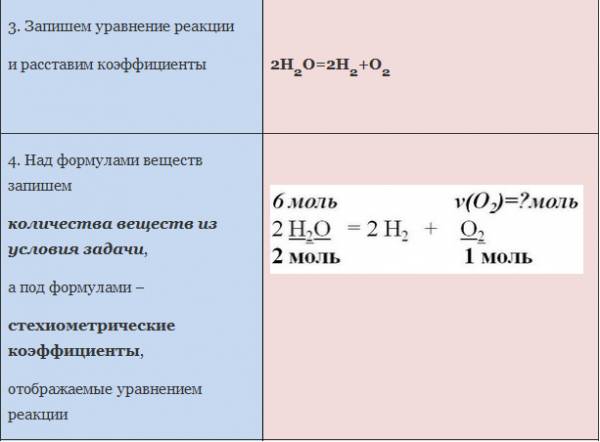
Рис. 1. Оформление краткого условия и решения задачи 1
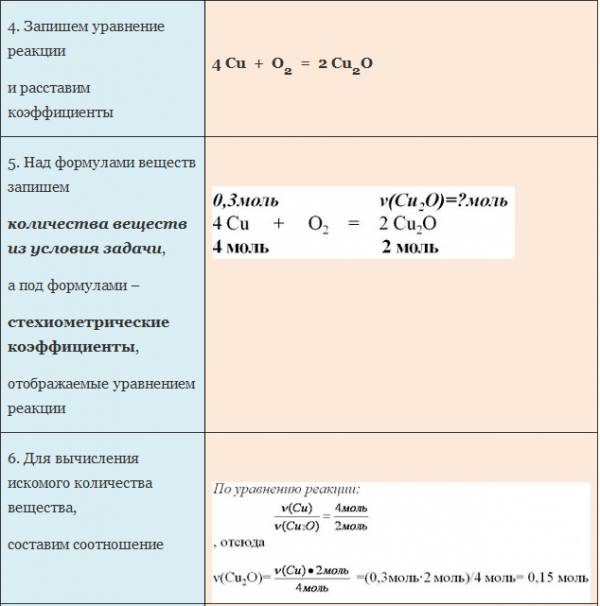
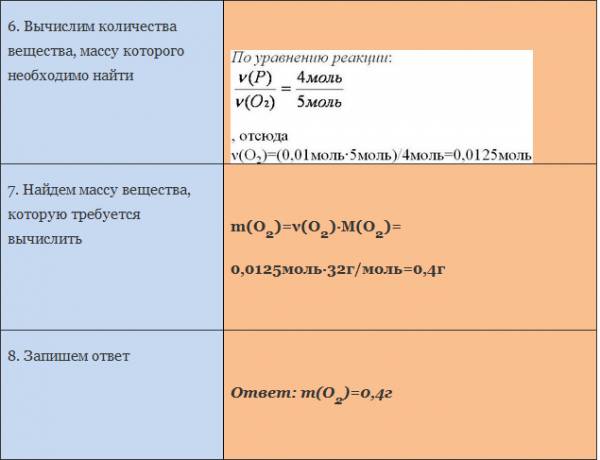
ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди?
Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.
Рис. 2. Оформление краткого условия и решения задачи 2.
I. Используя алгоритм, решите самостоятельно следующие задачи:
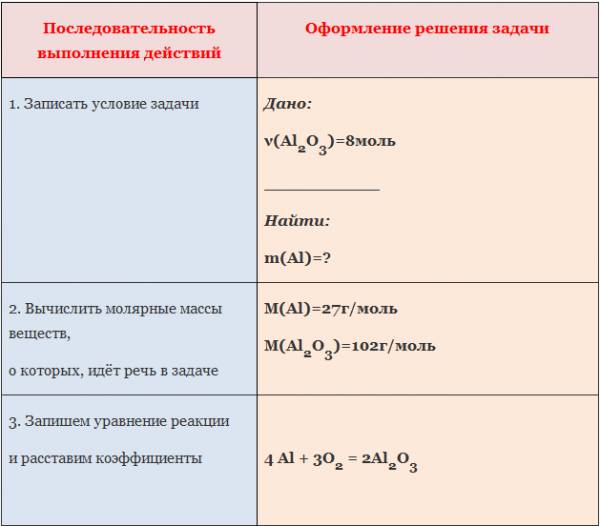
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
II. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
III. Используя алгоритм, решите самостоятельно следующие задачи:
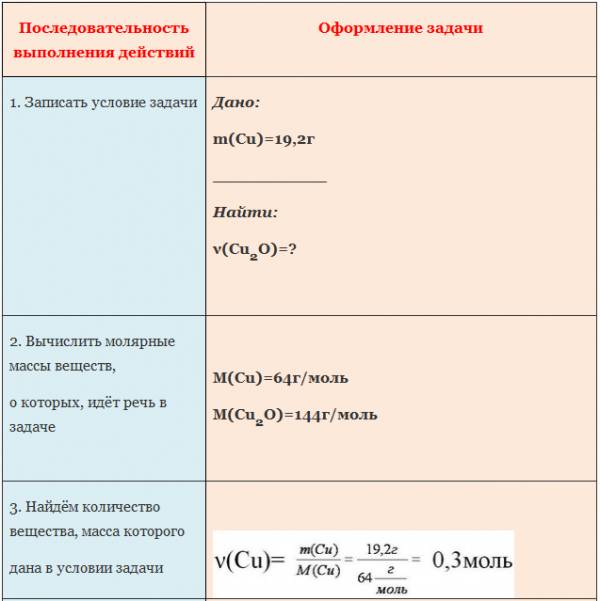
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
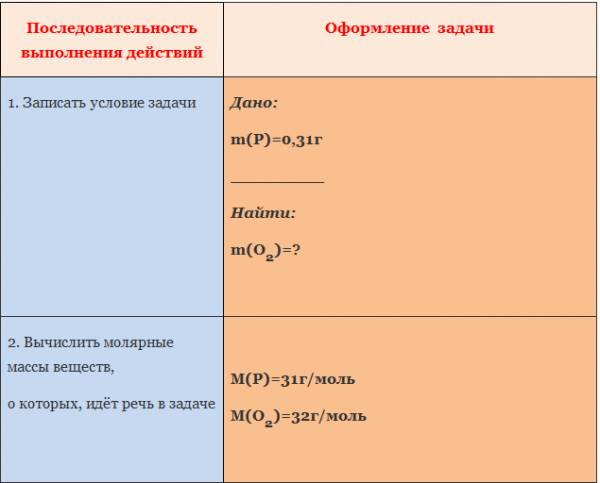
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
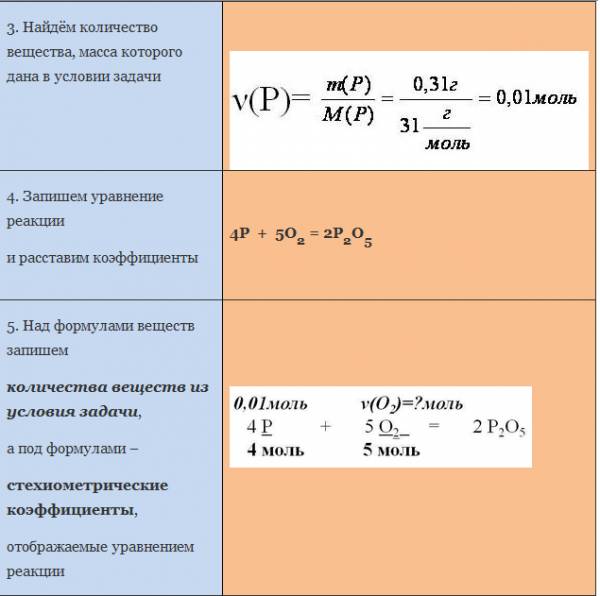
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Рассмотрим уравнение реакции образования воды из простых веществ:
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода.
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и молярную массу. Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной молекулярной массе. Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н.у.), используя известную вам формулу, в соответствие с которой объем газа при н.у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
ЗАДАЧА 2. Рассчитаем объем кислорода (при н.у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н.у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н.у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н.у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.
Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
ИСТОЧНИКИ
исчтоник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii
источник видео — http://www.youtube.com/watch?v=wZbj-o5J5Vs
источник видео — http://www.youtube.com/watch?v=8sPwPk7a7p0
источник видео — http://www.youtube.com/watch?v=ygaarSGQDwE
источник видео — http://www.youtube.com/watch?v=Gv-jZX0wZxE
Файлы
Нет дополнительных материалов для этого занятия.
http://www.chem-astu.ru/chair/study/genchem/r1_3.htm
http://www.kursoteka.ru/course/2183/lesson/6956/unit/18148/1