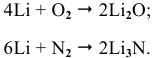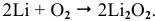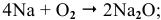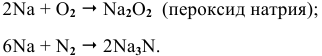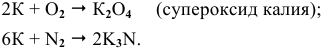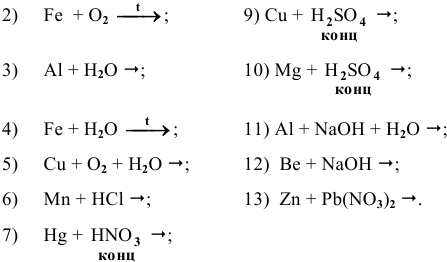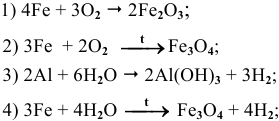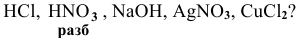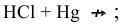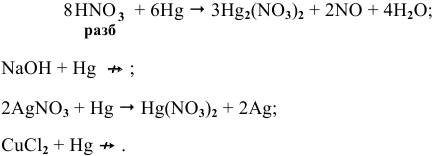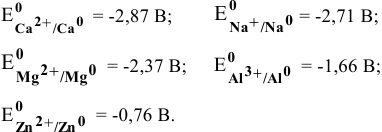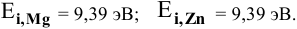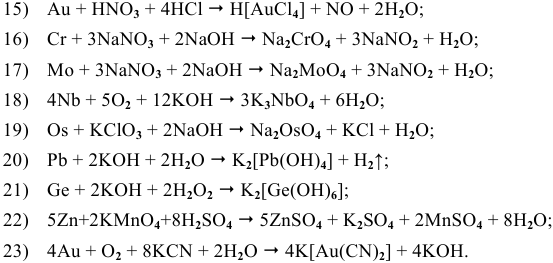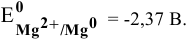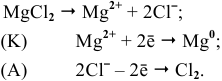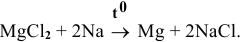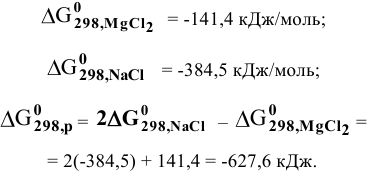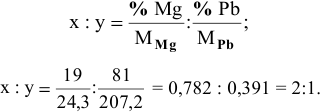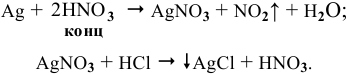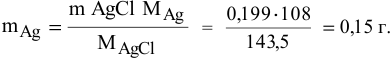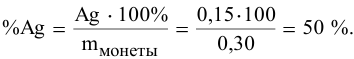Задачи с решениями на химические свойства металлов
Химические свойства металлов
Задача 81
Написать уравнения реакций окисления следующих щелочных металлов: 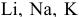
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
При высоких температурах вместо оксида лития образуется пероксид лития:
Натрий: а) при обычной температуре —
б) при высоких температурах —
Калий: а) при обычной температуре — 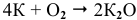
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:

Решение:
5) Электрохимическая коррозия меди с кислородной деполяризацией:
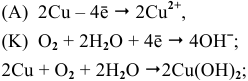
Задача 83
С какими из следующих веществ может реагировать ртуть:
Решение:
Задача 84
Среди металлов: 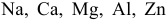
а) в водных средах;
б) в неводных средах.
Решение:
В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала. Для изучаемых металлов величины стандартных электродных потенциалов следующие:
Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
Величины энергий ионизации изучаемых металлов находим в справочнике:
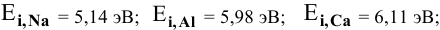
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
Составить и уравнять с помощью электронного баланса ОВ реакции.
Решение:
Ниже приводятся уравнения уже составленных и уравненных реакций:

Задача 86
Каким методом может быть получен металлический магний?
Решение:
Магний — это очень активный металл, его электродный потенциал
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава 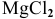
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
Докажем возможность использования Na:
Так как 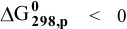
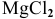
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
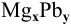
Таким образом, формула интерметаллического соединения — 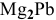
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной 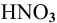
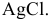
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
Согласно уравнениям этих двух реакций, 1 моль 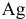
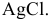
Рассчитаем массу серебра, соответствующую 0,199 г 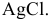
Вычислим процентное содержание серебра в монете:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Задачи по теме » Металлы «
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.


При сжигании 10 г металла было получено 18,9 г оксида, при этом металл окислился до степени окисления +3. Что это за металл, и какой объем кислорода был израсходован при этом.
Составим уравнение сжигания металла в общем виде:
4 Ме + 3 О2
Пусть количество Ме будет х моль тогда по уравнению реакции:



Mrx +24 x — Mrx =8,9
Найдем молярную массу металлов 
Примечание: если в задаче не указаны условия мы принимаем их как нормальные (н.у.).
Задачу можно решить и более простым путем:
Когда была найдена масса присоединившегося кислорода 8,9 г можно найти и его количество:


Ответ: неизвестный металл алюминий.
Образец кальция и натрия массой 6,3 г растворили в воде. Полученный раствор нейтрализовали азотной кислотой. Для нейтрализации потребовалось 18,9г HNO 3. Определите массу натрия в сплаве.
Составим уравнения реакции:
2 Na + 2HOH 
Ca + 2HOH 
NaOH + H no 3 
Ca(OH) 2 + 2HNO 3 
Находим количество затраченной азотной кислоты
Многие методики предлагают решать подобные задачи через систему уравнений. Мне же более простым, кажется другой способ решения.
0,3 моль HNO 3 затратилось на протекание реакции №3 и №4.
Обозначим кол-во HNO 3 затраченное в реакции №4 за х моль, тогда 
По уравнению №4 находим
По уравнению№3 находим
По уравнению №2 находим
По уравнению №1 находим
Выразим массы металлов:
m ( Na )=23(0,3-0,2)=2,3 (г)
Ответ: масса натрия равна 2,3 г
Определить массу меди в смеси железа, меди и алюминия, если при действии на 13 г этой смеси избытка раствора гидроксида натрия выделяется 6,72 л газа, а при действии избытка соляной кислоты 8,96 л газа (н.у.)
Составим уравнения реакций. С щелочами взаимодействуют только амфотерные металлы. В нашем случае это алюминий.
2 Al + 2 NaOH + 6 H 2 O 
При действии соляной кислоты реагировать будут железо и алюминий.
0 ,1 моль 0,1 моль
Fe + 2HCl 
0,2 моль 0,3 моль
2Al + 6HCl 
Находим количество водорода выделившегося в первой реакции:

Находим объем водорода выделившегося во 2 и 3 реакциях.


Следовательно, 

Ответ: масса меди в смеси равна 2 грамма.
Металлический магний массой 6 г опустили в 100 г раствора сульфата меди с массовой долей CuSO 4 8%. Определите массу металла к окончанию реакции.
Составляем уравнение реакции:
0,05 моль 0,05 моль 0,05 моль
Mg + CuSO 4 

По уравнению реакции определяем:
Ответ: масса металла после реакции равна 8 г.
Железную пластинку массой 8 г. некоторое время выдержали в растворе массой 200 г с массовой долей сульфата меди( II ) 15%, после этого масса пластинки составила 8,8 г. Определите массовую долю (в процентах) сульфата меди в растворе после реакции.
Составим уравнение реакции:
Fe + CuSO 4 
Находим массу сульфата меди II в исходном р-ре
Увеличение массы пластинки произошло потому, что масса выделившейся меди больше, чем масса железа вступившего в реакцию.


По уравнению реакции определяем
Ответ:
30 г магния опустили в раствор сульфата неизвестного металла, проявляющего степень окисления +2. Через некоторое время масса пластинки стала равной 39,5 г, а масса сульфата магния – 12 г. определите неизвестный металл.
Составляем уравнение реакции в общем виде:
0,1 моль 0,1 моль 0,1 моль
Mg + MeSO 4 

Ответ: неизвестный металл олово Sn .
Практикум. Решение задач по теме «Металлы»
Разделы: Химия
Расчеты по формулам.
Какое из следующих соединений содержит больше железа: FeO, Fe2O3, Fe3O4.
- *Минерал содержит 96% CuS. Какую массу этого минерала необходимо переработать, чтобы получить 100 г меди.
- *Из 1 т глинозёма, содержащего 95% оксида алюминия, получили 0,436 т алюминия. Каков процент выхода?
- *Сколько потребуется магнитного железняка, содержащего 90% Fe3O4 для получения 100 т железа, если потери в производстве составляют 3%.
*Сколько граммов кальция содержится в 300,0 г известняка, содержащего 90% карбоната кальция?
Расчёты по уравнениям:
1. дано: n(моль) – найти: n(моль).
Сколько моль оксида меди получится при полном окислении 3 моль меди?
2. дано: m (г, кг, т) – найти: m (г, кг, т).
Вычислите массу оксида меди полученного при окислении 6,4 г меди.
3. дано: m (г, кг, т) – найти:V (мл, л, м 3 ).
При обжиге известняка было получено 5,6 г оксида кальция. Какой объём углекислого газа(н.у.) при этом образовался.
4. дано: V (мл, л, м 3 ).– найти: m (г, кг, т)
 | Цинк растворили в соляной кислоте, и объём выделившегося газа составил 2,24 л (н.у.). Какая масса цинка была растворена? |
5. дано: m р-ра(смеси) и ω (%)в-ва(примеси) — найти: mв-ва или V в-ва
В 400 г 16,6 %-ного раствора азотной кислоты, растворили гидроксид меди(II). Какая масса соли получилась?
Какую массу 40% раствора гидроксида натрия необходимо взять, чтобы нейтрализовать 9,8 г серной кислоты.
7. дано: m 1 в-ва и m 2 в-ва — исходные вещества (какое-то их них находится в избытке)
найти: m 3 в-ва продукт реакции.
К раствору, содержащему 21,3 грамм нитрата алюминия, прилили раствор, содержащий 8 грамм гидроксида натрия, определите массу полученного осадка.
8. дано: m 1 в-ва исход. и m 2 в-ва — продукта реакции- практический выход —
найти: m 2 в-ва продукта реакции- теоретический выход. и ωвых
При действии концентрированной серной кислоты на кристаллический хлорид натрия массой 5,85 г было получено 2 л хлороводорода. Определите массовую долю выхода продукта реакции в (%) от теоретически возможного.
9. дано: m 1 в-ва исход. и ωвых –
найти: m 2 в-ва продукта реакции- практический выход
315 г азотной кислоты полностью прореагировало с гидроксидом кальция. Вычислите массу полученного нитрата кальция, если доля его выхода составляет 80% от теоретически возможного.
10. дано: m 1 в-ва продукта реакции- практический выход и его ωвых –
найти: m 2 в-ва исход.
Сколько граммов сульфида меди(II) потребуется сжечь, чтобы получить 17,92 л (н.у.) оксида серы (IV), если выход продукта реакции составляет 90%?
11. дано: m смеси, m в-ва (или V в-ва) прод. реакции, —
найти: mв-ва и его долю — ω (%)в-ва в смеси.
А).В реакцию вступает один компонент.
4,5 г сплава меди с магнием растворили в соляной кислоте. Объём выделившегося водорода составил 3,36 л (н.у.). Какова массовая доля магния в сплаве.
- При восстановлении водородом 40 г смеси меди с оксидом меди(II) образовалось 6 г воды. Определите массовую долю (в %) каждого компонента в смеси.
- Определите массовую долю каждого компонента в смеси, образующейся в результате взаимодействия 27 г порошкообразного алюминия и 64 г оксида железа(III).
- Какая масса 20% соляной кислоты потребуется для полного растворения 10 г смеси цинка с оксидом цинка, если при этом выделился водород объёмом 2,24 л (н.у.).
- Определите массовую долю (в %) железа в сплаве с углеродом, если при обработке образца сплава массой 6 г соляной кислотой выделилось 2,24 л газа (н.у.). Какой объём соляной кислоты (ρ= 1,09г/мл) с массовой долей HCl 18,25% вступил в реакцию.
- При взаимодействии со щелочью 4,5 г сплава алюминия с магнием выделилось 3,36 л водорода (н.у.). Какова массовая доля алюминия в сплаве?
- Через известковую воду пропустили 1 л смеси оксида углерода (II) и оксида углерода(IV). Выпавший осадок отфильтровали, промыли и просушили. Его масса составила 2,45 г. Определите объёмную долю каждого газа в исходной смеси.
- 4 г смеси кремния, алюминия и оксида магния обработали избытком соляной кислоты. Объём выделившегося газа составил 2,24 л, а масса нерастворившегося остатка составила 1,2 г. Определите количество вещества оксида магния в смеси.
- При растворении 4,5 г оксида меди(II), загрязнённого песком, был использован 16%-ный раствор азотной кислоты объёмом 36,1 мл (ρ= 1,093г/мл). Рассчитайте массы чистого оксида меди и песка, содержащихся в навеске.
В реакцию вступает два компонента. (Составляется 2 уравнения химических реакций и алгебраическое уравнение или система уравнений.)
- При взаимодействии смеси порошков железа и цинка массой 6,05 г с избытком раствора хлорида меди(II) образовалась металлическая медь массой 6,4 г. Определите количественный состав исходной смеси.
- Для растворения смеси карбоната кальция и карбоната магния в воде потребовалось 2,016 г углекислого газа (н.у.) определите количественный состав смеси карбонатов.
- При взаимодействии 30,7 г смеси цинка и алюминия, в разбавленной серной кислоте выделился водород объёмом 11,2 л (н.у.). Вычислите массовую долю цинка в смеси.
- На нейтрализацию 100 г раствора, содержащего 5,7 г смеси гидроксида натрия и кальция, израсходовали 9,45 г азотной кислоты. Вычислите массовые доли (в %) солей в исходной смеси.
- * Смесь железа с оксидом железа(II) и оксидом железа (III) обработали соляной кислотой и получили 112 мл водорода. 1 г этой же смеси при восстановлении водородом даёт 0,2115 г воды. Определите массовую долю оксида железа в смеси.
http://infourok.ru/zadachi-po-teme-metalli-983130.html
http://urok.1sept.ru/articles/571536