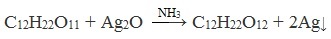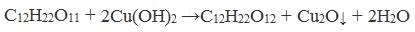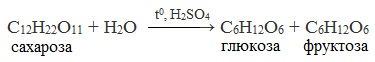Составьте уравнения реакций сахарозы с водой ; гидроксидом кальция ; кислородом (полное окисление) и укажите условия их протекания?
Химия | 5 — 9 классы
Составьте уравнения реакций сахарозы с водой ; гидроксидом кальция ; кислородом (полное окисление) и укажите условия их протекания.
2Na + 2H2O = 2NaOH + H2 гидроксид натрия и водород
K2O + H2O = 2KOH гидроксид калия
CaO + H2O = Ca(OH)2 гидроксид кальция.
Составьте уравнение реакции между карбонатом калия и хлоридом кальция в молекулярном, полном и сокращенном ионных видах?
Составьте уравнение реакции между карбонатом калия и хлоридом кальция в молекулярном, полном и сокращенном ионных видах.
Определите условие возможности протекания этой реакции.
Составьте уравнения реакций, укажите условия их протекания , назовите органические вещества : а) пропан + Cl2?
Составьте уравнения реакций, укажите условия их протекания , назовите органические вещества : а) пропан + Cl2.
Используя металлический кальций воду и кислород получите гидроксид кальция составьте уравнение всех необходимых реакций?
Используя металлический кальций воду и кислород получите гидроксид кальция составьте уравнение всех необходимых реакций.
Составьте полное и краткое уравнение реакций : гидроксид кальция с соляной кислотой?
Составьте полное и краткое уравнение реакций : гидроксид кальция с соляной кислотой.
Составьте уравнение хим?
Составьте уравнение хим.
Реакций, укажите условия протекания : СО2 — О2 — WO3 — W очень нужно!
Дописать уравнение реакции : HCl + Zn = ZnCl2 + ?
Составьте реакцию разложения воды.
Решите задачу : Какой объем кислорода потребуется для окисления 1, 5 моль серы?
Валентность серы — 4 Заранее огромное спасибо!
Составьте уравнение реакции, укажите условие протекания и назовите вещества : C6H6 — — C6H5Br?
Составьте уравнение реакции, укажите условие протекания и назовите вещества : C6H6 — — C6H5Br.
СОСТАВЬТЕ УРАВНЕНИЯ РЕАКЦИЙ И УКАЖИТЕ УСЛОВИЯ ИХ ПРОТЕКАНИЯ C2H5OH — > ; C2H4 — > ; C2H5CI?
СОСТАВЬТЕ УРАВНЕНИЯ РЕАКЦИЙ И УКАЖИТЕ УСЛОВИЯ ИХ ПРОТЕКАНИЯ C2H5OH — > ; C2H4 — > ; C2H5CI.
Напишите в виде сокращенного и полного ионных уравнений реакции взаимодействия карбоната натрия и хлорида кальция?
Напишите в виде сокращенного и полного ионных уравнений реакции взаимодействия карбоната натрия и хлорида кальция.
Объясните условия протекания реакций.
Составьте уравнения всех возможных химических реакций между веществами : кальций, оксид углерода, гидроксид натрия, кислород соляная кислота, карбонат кальция, этан?
Составьте уравнения всех возможных химических реакций между веществами : кальций, оксид углерода, гидроксид натрия, кислород соляная кислота, карбонат кальция, этан.
Составте полные и сокращенные ионные уравнения для двух химических реакции.
Напишите уравнение реакций : кислород — оксид кальция — гидроксид кальция?
Напишите уравнение реакций : кислород — оксид кальция — гидроксид кальция.
На странице вопроса Составьте уравнения реакций сахарозы с водой ; гидроксидом кальция ; кислородом (полное окисление) и укажите условия их протекания? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
Я не уверен , но можно попробовать решетом.
Гидролиз сахарозы — уравнение реакции, формула и свойства
Сахароза — природный углевод, являющийся химическим органическим соединением. Его относят к дисахаридам, так как в его структуре содержится два моносахаридных звена: остатки молекул глюкозы и фруктозы, соединенных через гидроксильную группу. В быту сахарозу называют тростниковым (иногда свекловичным) сахаром.
Общие свойства
Внешне сахароза выглядит как бесцветные мелкие кристаллы. Ее физические свойства:
- в воде, этаноле растворима, однако практически не растворяется в метаноле и диэтиловом эфире;
- температура плавления равна 186 градусов по Цельсию. При застывании расплавленной массы получается аморфное прозрачное вещество, называемое карамелью;
- в природе находится в овощах, фруктах и ягодах.
Получение сахарозы
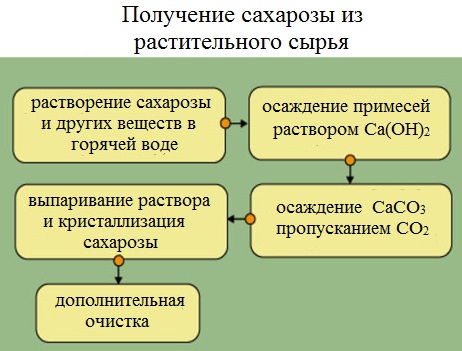
Получение — довольно сложный и тонкий процесс. Для этого сахарный тростник или свеклу измельчают до мелких опилок и переносят в громадные диффузоры.
В них происходит процесс вымывания сахарозы под действием горячей воды.
Так как совместно с С12Н22О11 в раствор попадают примеси, для отделения данных продуктов через раствор пропускают гидроксид кальция Ca (OH2). После такой процедуры происходит образование почти нерастворимых солей, выпадающих в осадок (CaCO3), и растворимого сахарата кальция С12Н22О11*СаО*2Н2О.
Следующим шагом углекислый газ (СО2) добавляют к получившемуся раствору с целью разделения сахарата кальция.
В результате в осадок выпадает карбонат кальция, который отфильтровывается, а оставшийся раствор выпаривают в специальных вакуумных аппаратах. Далее образующиеся кристаллики разделяются при помощи центрифуги. Оставшийся раствор называется меласса. Он широко применяется для получения лимонной кислоты.
Полученная сахароза подвергается дополнительным очисткам, кристаллизации и упариванию.
Сферы применения
Сахароза применяется во многих областях:
Химические свойства
Формула — C12H22O11. Она не проявляет восстановительных свойств, а реакции идут обычно по гидроксильным группам:
Гидролиз дисахаридов — химическая реакция, при которой вода вступает в реакцию с другими веществами.
Для дисахаридов характерна данная реакция (среда должна быть кислой либо необходимо присутствие фермента) с образованием моносахаридов, то есть происходит диссоциация. Чтобы гидролизоваться, нужна кислота.
Гидролизация происходит при высокой температуре и в присутствии ионов водорода. В результате она расщепляется до молекулы глюкозы и молекулы фруктозы.
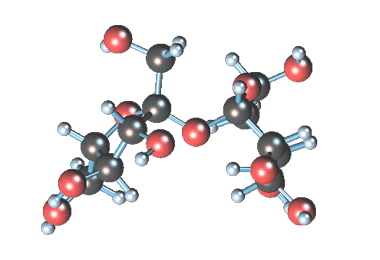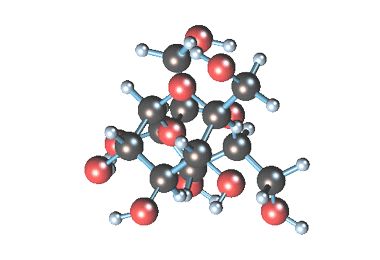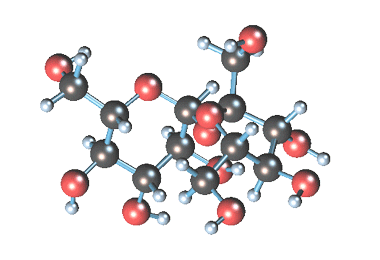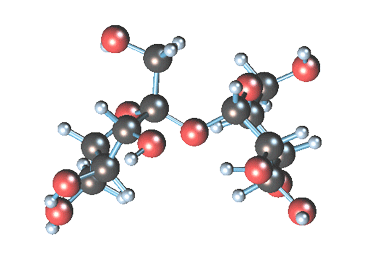
Уравнение реакции гидролиза сахарозы можно написать следующим образом: C12H22O11+H2O=C6H12O6 (глюкоза)+C6H12O6 (фруктоза).
Из моносахаридов можно получить дисахариды обратной реакцией. А также в живых существах данная реакция происходит при участии различных ферментов. Скорость протекания реакции зависит от количества С12Н22О11 в растворе.
Составьте уравнение реакции сахарозы с водой
Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
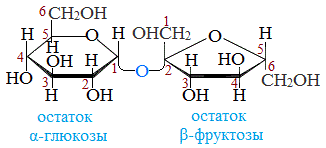
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11 .
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
Для сахарозы характерны реакции по гидроксильным группам.
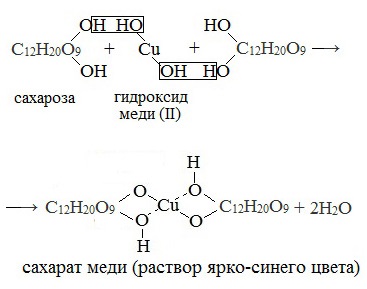
1. Качественная реакция с гидроксидом меди (II)
Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):
2. Реакция окисления
Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
Реакция «серебряного зеркала»
Реакция с гидроксидом меди (II)
Невосстанавливающий дисахарид
Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
3. Реакция гидролиза
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Видеоопыт «Кислотный гидролиз сахарозы»
Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
В живых организмах гидролиз дисахаридов происходит при участии ферментов.
Получение сахарозы
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.). чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок. Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.
Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).
http://kupuk.net/uroki/himiya/gidroliz-saharozy-yravnenie-reakcii-formyla-i-svoistva/
http://himija-online.ru/organicheskaya-ximiya/uglevody/saxaroza.html