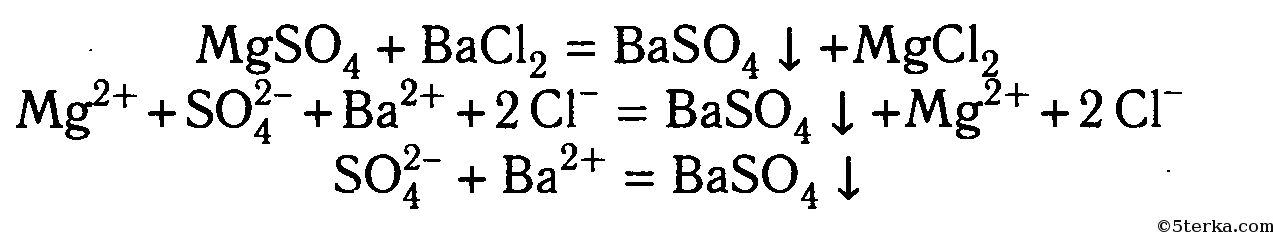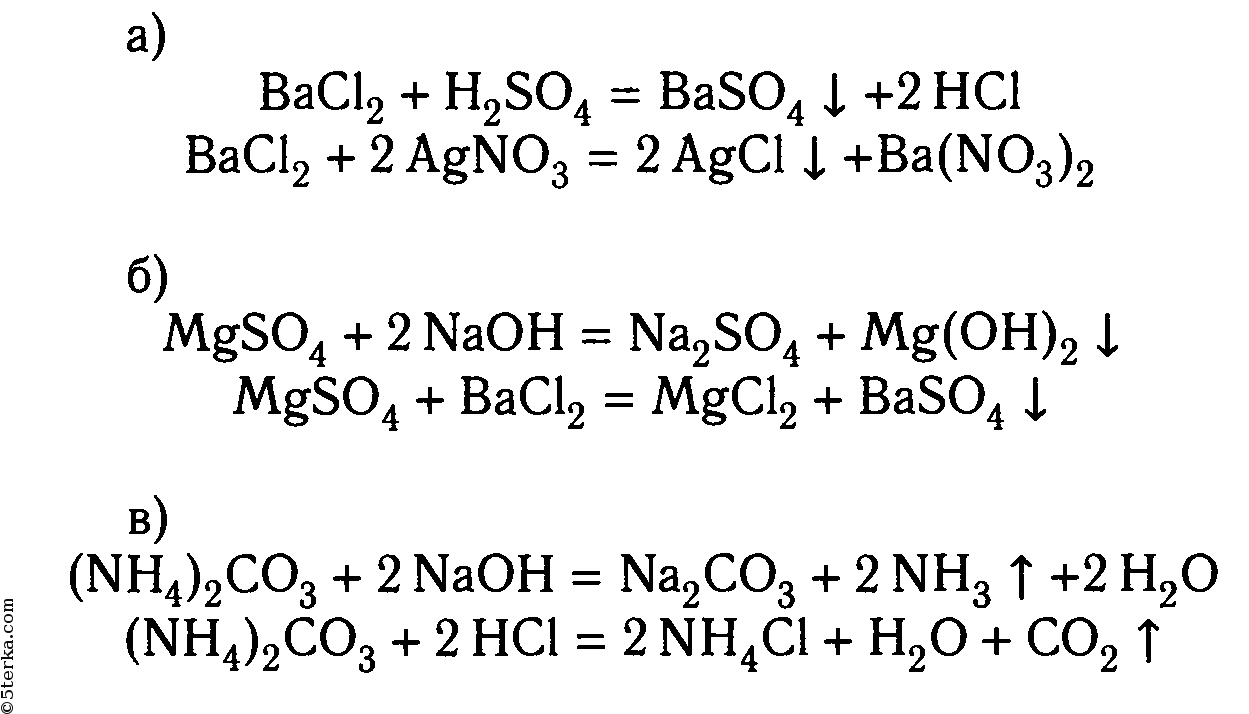Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e00012dd8087a4e • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Практическая работа № 6. Ионные реакции
Обнаружение сулъфат-ионов SO4 2-
В одну пробирку налейте 1—2 мл раствора сульфата натрия, а в другую — 1—2 мл раствора сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое.
Составьте уравнения электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите полное и сокращенное ионные уравнения реакции.
Какие соединения могут служить реактивом на ионы бария Ва 2+ ?
В чем сущность обнаружения ионов с помощью реактива?
Сущность обнаружения ионов с помощью реактива заключается в том, что реакции с ними обнаруживаемого иона, избирательна для данного иона. Такая реакция называется аналитической. Аналитическая реакция сопровождается выделением газа, выпадением осадка или изменением цвета раствора.
Обнаружение хлорид-ионов Cl
По таблице растворимости выясните, какие соли, содержащие хлорид-ион Cl — , нерастворимы (малорастворимы). При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид-ионы.
Составьте уравнения диссоциации солей, реакции обмена и полные и сокращенные ионные уравнения проведенных реакций.
Обнаружение сульфат-ионов SO4 2- и хлорид-ионов Cl —
В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой — раствор сульфата магния?
Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну пробирку раствор нитрата свинца (II), в другую — раствор хлорида бария. В какой из пробирок выпал осадок? Какая из солей — KCl или MgSO4 — содержится в первой пробирке?
Раствор из второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (II). Объясните наблюдаемое.
Составьте уравнения реакций обмена проведенных вами реакций и полные и сокращенные ионные уравнения реакций обнаружения ионов.
Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния; в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12.

задача №1
к главе «Глава 7. Свойства электролитов».
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
http://5terka.com/node/10323
http://chemege.ru/reakcii-ionnogo-obmena/