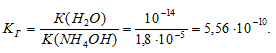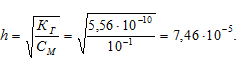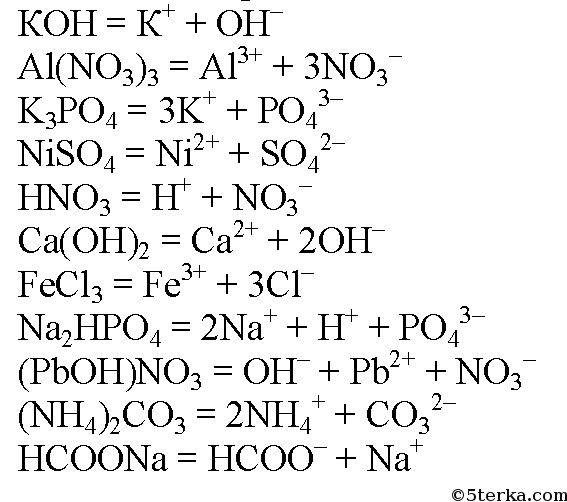Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df78aad0d03451c • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Определение реакции среды раствора соли
Задача 594.
Исходя из значений констант диссоциации соответствующих кислот и оснований, указать реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S.
Решение:
K(NH4OH) = 1,8 . 10 -5 ; K(HCN) = 7,9 . 10 -10 ; K(HF) = 6,6 . 10-4; K(H2S) = 6 . 10 -8 .
Так как соли образованы слабыми основаниями и слабыми кислотами, то при взаимодействии с водой они гидролизуются как по катиону, так и по аниону, В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих данную соль.
а) NH4CN — соль слабого основания и слабой кислоты, поэтому гидролизуется как по катиону, так и по аниону. Но так как K(HCN) . 10 -10 ) . 10 -5 )], то гидролизу преимущественно будут подвергаться анионы соли и реакция раствора будет преимущественно слабощелочной, рН > 7:
CN — + H2O ⇔ HCN + OH — .
б) NH4F. Так как K(HF) > K(NH4OH) [(6,6 . 10 -4 ) . 10 -5 )], то гидролизу преимущественно будут подвергаться катионы соли и реакция раствора будет преимущественно слабокислой рН
в) (NH4)2S. Так как K(H2S) . 10 -8 ) . 10 -5 )], то гидролизу преимущественно будут подвергаться анионы соли и реакция раствора будет преимущественно слабощелочной, рН > 7:
Задача 595.
При рН 6,3 — в желтый, при промежуточных значениях рН — в оранжевый цвет. Какова будет окраска индикатора в 0,1 М растворе ?
Решение:
K(NH4OH) = 1,8 . 10 -5 .
Уравнение гидролиза NH4Br:
Находим концентрацию ионов водорода:
[H + ] = h . CM = (7,46 . 10 -5 ) . (1 . 10 -1 ) = 7,46 . 10 -6 .
pH = -lg[H + ] = -lg7,46 . 10 -6 = 6 — lg7,46 = 6 — 0,87 = 5,13.
Так как pH > 3,1, но
Ответ: оранжевый.
Задача 596.
Раствор NaH2PO4 имеет слабокислую, а раствор Na3PO4 — сильно-щелочную реакцию. Объяснить эти факты и мотивировать их соответствующими ионно-молекулярными уравнениями.
Решение:
а) Так как NaH2PO4 — соль сильного основания и слабой кислоты, то гидролиз протекает по аниону:
В растворе проходит и диссоциация образовавшейся фосфорной кислоты:
При гидролизе данной соли образуется ортофосфорная кислота, которая при диссоциации даёт в раствор дополнительное количество ионов водорода, которых намного больше, чем гидроксид-ионов, что и придаёт раствору слабокислую реакцию. Это можно объяснить тем, что в рассмотренном примере константа диссоциации H3PO4 превышает константу гидролиза аниона H2PO4 — , поэтому раствор соли имеет слабокислую реакцию.
б) Так как Na3PO4 — соль сильного основания и слабой кислоты, то гидролиз протекает по аниону:
В растворе проходит и диссоциация образовавшейся фосфорной кислоты:
В рассмотренном примере одновременно протекают два процесса: гидролиз соли, идущий с образованием гидроксид-ионов; диссоциация кислоты, идущая с образованием ионов водорода. Так как константа гидролиза аниона HPO4 2- намного превышает константу диссоциации кислоты H3PO4, то в растворе будет избыток гидроксид-ионов, что и предаёт раствору сильно-щелочную реакцию.
3. Составьте уравнения диссоциации следующих электролитов: КОН, Al(NO3)3, K3PO4, NiSO4, HNO3, Са(ОН)2, FeCl3, NaHPO4, (PbOH)NO3, (NH4)2CO3, HCOONa.
3. Составьте уравнения диссоциации следующих электролитов: КОН, Al(NO3)3, K3PO4, NiSO4, HNO3, Са(ОН)2, FeCl3, NaHPO4, (PbOH)NO3, (NH4)2CO3, HCOONa.

задача №3
к главе «Глава 3. Химические реакции. §15. Электролитическая диссоциация».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
http://buzani.ru/zadachi/khimiya-glinka/1200-pravila-klechkovskogo-zadachi-175-182
http://5terka.com/node/11077