Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2170437a770c2d • Your IP : 85.95.188.35 • Performance & security by Cloudflare
составить уравнение электрической диссоциации электролитов HNO2;HNO3;NH4OH. Объяснить какой из них легче распадается
Объяснить какой из них легче распадается, на ионы и почему. записать выражение для константы равновесия слабых электролитов.
Азотная кислота — сильный электролит, распадается практически полностью: HNO3 = H(+) + NO3(-)
Азотистая кислота — слабая (Kd=5,1*10^-4): HNO2 H(+) + NO2(-) распадается на ионы примерно одна молекула из 2000!
Гидроксид аммония — самый слабый электролит (Kd = 1,8*10^-5): NH4OH NH4(+) + OH(-) распадается примерно одна молекула из 50000!
Задача № 2. 1 л 0,1М раствора НNO2 содержит 6,15×1022 недиссоциированных молекул и образовавшихся ионов
Читайте также:
|
1 л 0,1М раствора НNO2 содержит 6,15×10 22 недиссоциированных молекул и образовавшихся ионов. Определите степень диссоциации азотистой кислоты.
Определим количество недиссоциированных молекул и образовавшихся ионов:
n(частиц) = 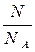
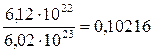
HNO2 H + + NO 
HNO2 H + + NO
nдис.(НNO2) = n(Н + ) = n(NO 
Количество недиссоциированных молекул НNO2 будет равно:
Общее число частиц в растворе складывается из числа образовавшихся ионов Н + и NO 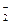
n(частиц) = n(Н + ) + n(NO 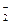
0,1 + х = 0,10216; х = 0,00216 моль.
Рассчитаем степень диссоциации: 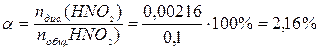
Упражнения и задачи для самостоятельного решения.
1. Как называются и чем различаются между собой следующие частицы: а) Cl – , Cl, Cl2; б) SO 
2. Напишите формулы электролитов, в водных растворах которых содержатся ионы:
а)Al 3+ и SO 
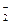
д) Cr 3+ и NO 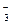
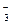
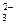
и) Na + и СlО 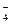
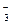
4. Составьте уравнения диссоциации следующих электролитов: (CuOH)2SO4; Al(OH)Cl2; K2HPO4; Na2S; Mg(HCO3)2; H2SO3; Fe(OH)2. Какие из этих электролитов образуют в растворе гидроксид-ионы?
5. Какие из следующих электролитов образуют в растворе одновременно ионы водорода и гидроксид-ионы: KOH; Sr(OH)2; H2O; Pb(OH)2; Cа(HCO3)2; Sn(OH)2; Cr(OH)3; Al(OH)3? Напишите уравнения электролитической диссоциации этих веществ.
6. Определите, какие из указанных электролитов являются сильными, а какие слабыми электролитами: Са(ОН)2, Н2СО3, СuSO4, H2SO4, Cu(OH)2, HF, H2S.
7. Напишите уравнения диссоциации Na3PO4, H2S, ZnSО4, Al(OH)2Cl и укажите степень диссоциации (a = 1; a
2. Определите общее число частиц в растворе, содержащем 0,1 моль слабой одноосновной кислоты, если степень ее диссоциации равна 2%. (Ответ: 6,14×10 22 )
3. При растворении кислот в воде образуется ион гидроксония Н3О + . Представьте схему образования этого иона? По какому механизму он образуется?
4. Составьте уравнения диссоциации электролитов СrCl3, KClO3, Al(OH)2Cl, Ca(ClO)2, HClO4, NaClO, MgOHCl. Какие из этих электролитов образуют в водном растворе хлорид-ионы.
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.007 сек.)
http://sprashivalka.com/tqa/q/6324437
http://studall.org/all-56412.html
