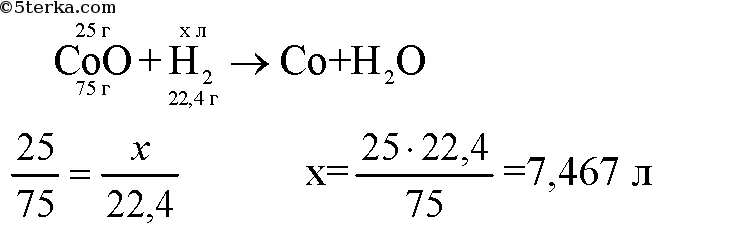Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Тема III. Работа 1. Получение и свойства водорода. Вариант 2
Вопросы:
1. Напишите уравнения реакций: а) магния с серной кислотой; б) водорода с оксидом молибдена(VI) MoO3; в) водорода с серой (сера в образующемся соединении двухвалентна).
2. В каком виде элемент водород встречается на Земле?
3. Рассчитайте массу водорода, который вступит в реакцию с 25 г оксида кобальта(II) CoO.
Уравнение реакции: CoO + H2 = H2O + Co
Решения и ответы:
2. Смесь водорода с кислородом, что возможно при надувании воздушных шаров и аэростатов, взрывоопасна.

задача №2
к главе «Тема III. Водород. Кислоты. Соли. Работа 1. Получение и свойства водорода».
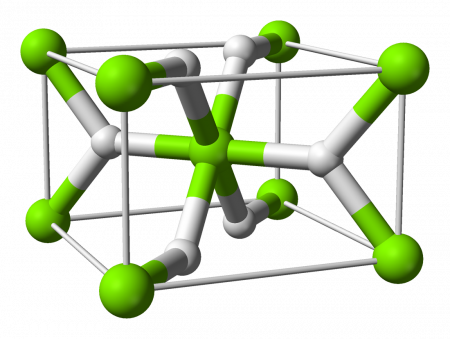
Гидрид магния
| Гидрид магния | |
|---|---|
 | |
| Хим. формула | MgH2 |
| Молярная масса | 26,3209 г/моль |
| Плотность | 1,45 г/см³ |
| Температура | |
| • плавления | 327 °C |
| Рег. номер CAS | 7693-27-8 |
| PubChem | 107663 |
| Рег. номер EINECS | 231-705-3 |
| SMILES | |
| ChemSpider | 16787263 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрид магния (Магний водородистый) — бинарное неорганическое химическое соединение с химической формулой MgH2.
Содержит 7,66 % вес. водорода, в связи с чем рассматривается в качестве возможной среды для хранения водорода.
Свойства
Представляет собой твёрдое белое нелетучее вещество. Мало растворим в воде. Взаимодействует со спиртами и водой:
При нагревании свыше 287 °C при атмосферном давлении распадается на элементы:
Относительно высокая температура разложения рассматривается как некоторый недостаток для применения вещества в качестве обратимого хранилища водорода.
Получение
Гидрид магния получают реакцией магния с водородом при 570 °С и около 200 атмосфер в присутствии катализатора — йодида магния (выход реакции 60 %):
Также возможно получение вещества взаимодействием гидрида лития LiH с магнийалкилами.
http://5terka.com/node/11278
http://chem.ru/gidrid-magnija.html