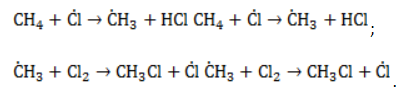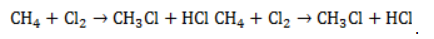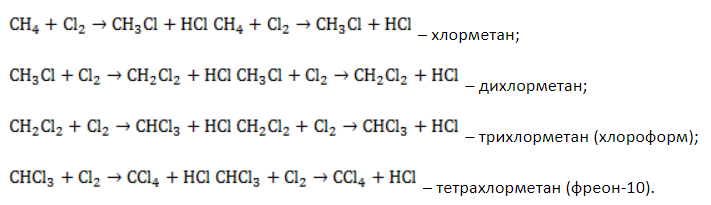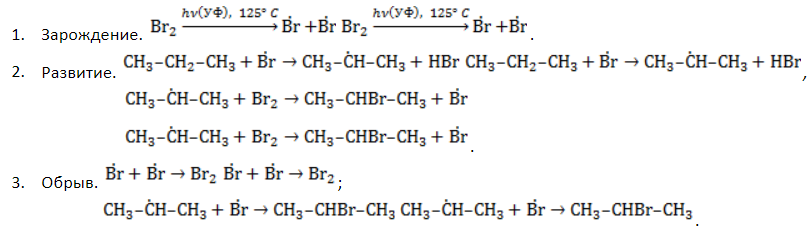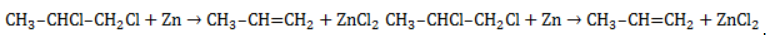Получение метанола без катализаторов, высоких температур и давления

Хлор получают электролизом раствора поваренной соли:
2NaCl → 2Na + + 2Cl — — электролиз → 2Na + Cl2,
в растворе вместо металлического натрия на катоде получается щёлочь и водород (NaOH и H2), а на аноде нужный нам хлор (Cl2).
Характерные особенности взаимодействия метана с хлором: реакция не идет в темноте при низких температурах, хлор взаимодействует с метаном при ультрафиолетовом облучении или при высоких температурах, реакция экзотермична — протекает с выделением тепла и без контроля может привести к взрыву.
Общая схема реакции хлорирования метана такова:
Стадии процесса:
- I стадия Cl2 → 2Cl — (на свету) (зарождение цепи)
- II стадия Cl — + H — CH3 → HCl + — CH3 (развитие цепи)
- III стадия — CH3 + Cl2 → CH3Cl + Cl — (развитие цепи)
- IV стадия Cl — + CH3Cl → HCl + — CH2Cl2 (развитие цепи) и т.д.
- V стадия H3C — + — CH3 → H3C — CH3 (обрыв цепи)
- VI стадия Cl — + — CH3 → CH3Cl (обрыв цепи)
I, II (или III, IV) и V (или VI) — последовательные стадии, II, III, IV и V, VI — параллельные.
CH3Cl — хлористый метил, используется в производстве кремнийорганических соединений. Молекулярная масса = 50,5. Внешний вид — газ (у сжиженного температура кипения = -240 o С) . Горючий газ, образует с воздухом взрывоопасные смеси.
Итак: подвергаем раствор поваренной соли электролизу (1), полученные (2) CH3Cl + HCl обрабатываются раствором щёлочи (3), NaOH — остаётся после электролиза поваренной соли, что позволяет сделать зациклить процессы в установке.
В результате получаем раствор CH3OH и NaCl:
а также гасятся излишки соляной кислоты:
HCl + NaOH → NaCl + H2O
Чтобы из водного раствора выделить метанол, его достаточно просто перегнать в обычном самогонном аппарате-дистилляторе (4). В итоге получится метиловый спирт-первак крепостью около 80 o , в чем можно убедиться при помощи спиртометра.
Функциональная схема установки

Существенным недостатком этого способа получения метанола — является его огромная энергетическая затратность на электролиз (да и отходы, включая водород, просто теряются).
Однако, этот минус можно скомпенсировать — для этого потребуется автономная энергоустановка (предпочтительней дизель-генератор), работающая на метане от газовой сети (туда же скармливаются газообразные отходы и бесполезный водород).
Это естественно удорожит конечную стоимость полученного жидкого топлива, но если нет счётчиков на газовой трубе — то и нет этой проблемы, в принципе народ и электричество левым путём умеет тратить, но тут надо будет постараться, чтобы скрыть факт постоянной недостачи в несколько кВт/ч!
Немного посчитаем.
Согласно закону Фарадея, для выделения на электроде 1 моля вещества (в частности хлора Cl2) требуется пропустить через раствор 96500 кулонов электричества. Если пытаться переработать 1м 3 метана/ч, что соответствует приблизительно 44 молям/ч, в хлористый метил, нам необходимо электролизом получать порядка 22 моля Cl2 в час, что эквивалентно току электролиза в 590А.
Сколько вольт надо подавать на одну ячейку электролизера, сходу не скажу, все зависит от конструкции, но, для простоты предположим, надо 2В (реально вполне можно расчитать сопротивление идеальной ячейки из 2-х листов металла, помещенных в раствор соли). Два вольта — это величина порядка стандартных электрохимических потенциалов, но сколько точно — надо считать.
Ну, а теперь, умножаем 590А на 2В, получается — 1.18 кВт/м 3 .
Само собой еще надо учесть КПД электролизеров, а он обычно небольшой. Так что надо умножать потребляемую мощность как минимум на 2, а может и на 4.
Можно ячейки соединить последовательно, это позволит уменьшить ток, увеличив напряжение, но потребляемая мощность, естественно, останется такой же.
Можно посчитать энергетические затраты исходя из энергии образования NaCl из простых веществ, энергия разложения будет эквивалентна, плюс энергетические потери на разогрев всех электрических цепей.
Но я, наверное, этого делать не стану. Навскидку, способ кажется мне весьма энергоемким и потому малоперспективным (применительно к метанолу). Однако, если посмотреть на это дело с другой сторону, то допустим, на переработку одного кубометра метана требуется максимум 4 кВт*ч, стоит эта энергия 9 рублей, а с учётом всяких потерь и отходов, ну пусть будет 12 рублей. Один кубометр метана, примерно, соответствует 1 литру бензина (на самом деле больше, чем литр), и даже при легальном расходе электроэнергии и метана, получается всё-равно в два раза дешевле, чем стоимость литра бензина (или диз. топлива).
Хлорирование метана
Вы будете перенаправлены на Автор24
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^\circ \ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Итак, если смесь метана с хлором нагреть до $200^\circ \ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
Рисунок 1. Хлорирование метана
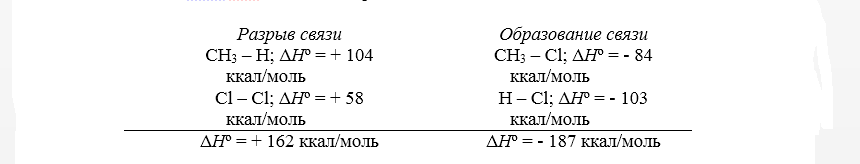
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
Рисунок 2. Хлорирование метана
Суммарный тепловой эффект $\Delta \underline
Готовые работы на аналогичную тему
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
Рисунок 3. Хлорирование метана
Рисунок 4. Хлорирование метана
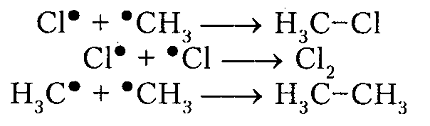
обрыв цепи (рекомбинация)
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h \nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 \ 000$ и более.
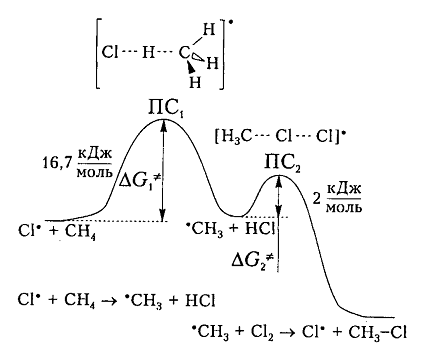
На рис. 6 показана энергетическая диаграмма хлорирования метана.
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи — связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой $<\rm H>-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах — плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов ( кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Галогенирование алканов на примере пропана
Галогенирование – процесс присоединения к молекуле органического соединения атома галогена – это одно из химических взаимодействий, в которых участвуют углеводороды ряда алканов. Благодаря общности структуры молекул у всех членов гомологического ряда реакции с галогеном обладают единым характером. При этом галогенирование пропана и следующих за ним в гомологическом ряду соединений имеет особенности, связанные с наличием в молекулах вторичных, третичных и четвертичных атомов углерода.
Краткая характеристика алканов
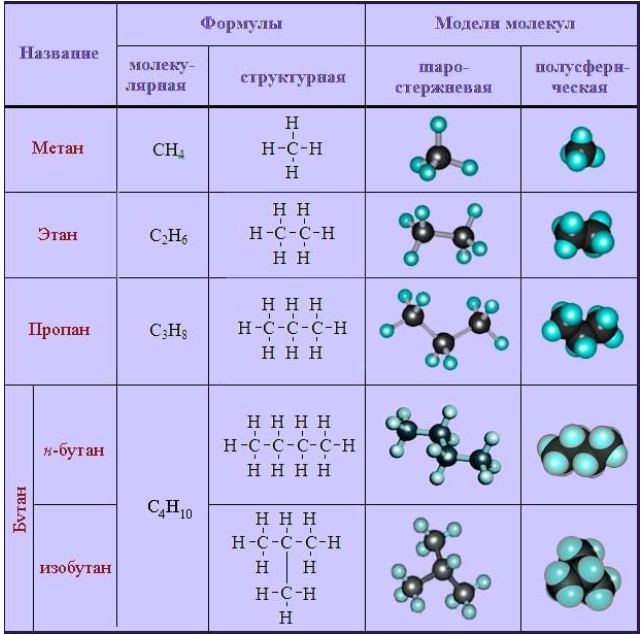
К простейшим органическим соединениям относятся ациклические насыщенные, или предельные углеводороды (алканы). Их отличают следующие структурные особенности:
- неразветвленные (прямые) или разветвленные молекулы, не содержащие циклических образований;
- все химические связи в молекуле – одинарные.
Общая формула имеет вид 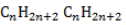
Механизм замещения у алканов носит радикальный характер, так как разрыв слабополярной связи C-H протекает с образованием пары свободных радикалов – нейтральных частиц, имеющих по одному неспаренному электрону. Атом водорода может замещаться галогеном, нитрогруппой или сульфогруппой.
Галогенирование алканов
Реакция свободно-радикального замещения (обозначается символом SR – от англ. substitution radical reaction) водородного атома в молекуле алкана атомом галогена называется галогенированием. Ее инициирование требует воздействия ультрафиолетового облучения или повышенной температуры. Реакция носит цепной характер, так как в каждом ее акте образуются свободные радикалы, генерирующие следующий акт.
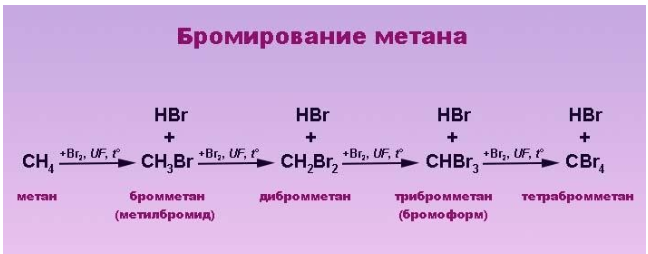
Замещение фтором – фторирование – чрезвычайно экзотермический процесс, сопровождающийся взрывом и разрушением молекулы алкана. Реакция с участием йода, наоборот, является эндотермической и обратимой – в ходе ее происходит восстановление продукта реакции йодоводородом, поэтому прямое йодирование неэффективно. Практический интерес представляют реакции алканов с хлором и бромом.
Стадии галогенирования
Удобнее всего рассмотреть, какой механизм имеет реакция хлорирования алканов, на примере метана. При облучении или нагреве реакционной смеси реакция инициируется, и далее цепная реакция протекает в несколько стадий.
- Зарождение цепи – распад молекулы хлора на активные радикалы:
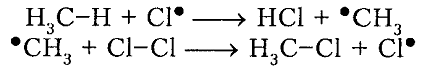
- Развитие цепи. Взаимодействуя с молекулой метана
, радикал
отщепляет от нее атом водорода с образованием метил-радикала
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
- Обрыв цепи. Цепной процесс прекращается, когда радикалы реагируют между собой:
В общем виде уравнение галогенирования метана хлором записывается в форме:
Процесс замещения не ограничивается образованием хлорметана, на молекулы которого также воздействуют радикалы 
Выход продуктов зависит от мольного соотношения реагентов и условий реакции. Так, при эквимолярном количестве метана и хлора и температуре 440° C соотношение молярных долей продуктов в процентах составляет около 39:41:19:1.
Реакция бромирования отличается меньшим выделением энергии и протекает медленнее, так как его реакционная способность ниже, чем у хлора.
Региоселективность
Начиная с пропана 
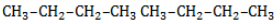
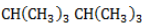
Селективность зависит от следующих факторов:
- Активность реагента. Чем активнее галоген, тем слабее проявляется избирательность при замещении водорода. Так, при взаимодействии алкана с хлором региоселективность значительно меньше, чем в реакциях с бромом, или не наблюдается.
- Температура. Нагревание ведет к снижению селективности.
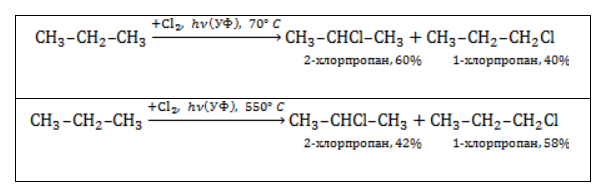
Хлорирование и бромирование пропана
В реакции пропана с хлором при низкой температуре селективная направленность выражена слабо. Несмотря на то, что образующиеся в ходе реакции радикалы 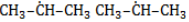
При нагревании радикалы хлора атакуют первичные атомы даже более активно, так как на разрыв их связи с водородом затрачивается меньше энергии.
При бромировании пропана региоселективность вследствие меньшей активности брома достигает высоких значений:
Бромирование протекает аналогично реакции с участием простейших алканов с преимущественным замещением водорода у вторичных атомов:
Продуктом этой реакции является 2-бромпропан.
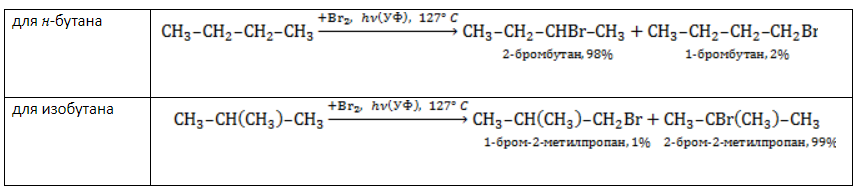
Галогенирование бутана
В реакциях бутана с хлором селективность не играет заметной роли. Даже при низкой температуре соотношение продуктов хлорирования может быть различным:
Бромирование бутана демонстрирует большую селективность:
Реакция отщепления
Активные двухвалентные металлы (как правило, магний или цинк) отщепляют от молекул дигалогеналканов атомы хлора или брома, если они замещают водород у двух соседних атомов углерода. Между последними образуется двойная связь. Продуктом такой реакции является алкен.
Пример реакции дегалогенирования алканов – отщепление цинком атомов хлора от 1,2-дихлорпропана с образованием пропилена (пропена) и хлорида цинка:
Применение галогеналканов
Хлорированные и бромированные алканы применяются в качестве промежуточных соединений в различных отраслях, таких как синтез высокомолекулярных соединений, производство лаков, красок и растворителей. Хлоралканы служат сырьем для фторалканов, которые нельзя получить прямым фторированием.
Токсичность галогеналканов тем меньше, чем активнее входящий в их состав галоген. Поэтому фторалканы наиболее безопасны. Фторсодержащие фреоны широко используются в качестве вспенивателей, хладагентов и пропеллентов.
http://spravochnick.ru/himiya/alkany_nomenklatura_alkanov/hlorirovanie_metana/
http://allinchemistry.ru/organicheskaya-himiya/galogenirovanie-alkanov-na-primere-propana
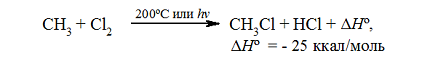
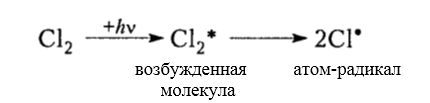
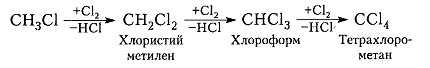
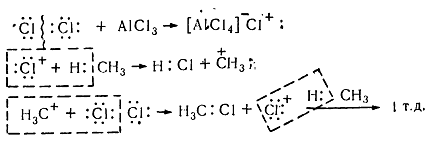


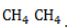 , радикал
, радикал 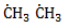 , который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию: