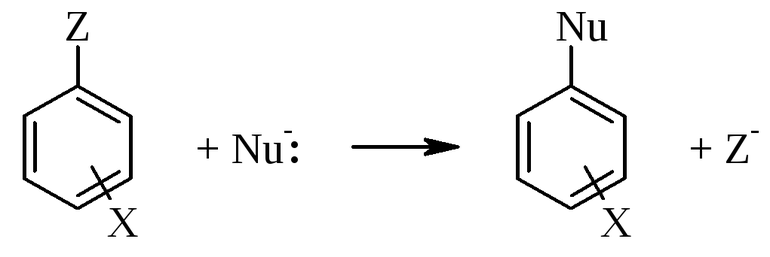11 класс
- Как вы можете объяснить такие термины, как «твердые растворы» и «жидкие кристаллы», которые на первый взгляд не соответствуют традиционным представлениям о растворах и кристаллах. Какими свойствами обладают твердые растворы и жидкие кристаллы?
Химик получил образцы трех металлов серебристо-белого цвета и нашел способ как их быстро различить. Для этого он подверг образцы действию кислот и раствора гидроксида натрия. Результаты его исследования представлены ниже.
водный раствор
Условные обозначения : «+» — реакция идет, «–» — металл не реагирует.
Определите какие металлы могли быть получены химиком и напишите соответствующие уравнения реакций.
После обработки смеси двух сложных эфиров избытком раствора щелочи в полученном водном растворе найдены следующие вещества: глицерин, фенолят натрия, ацетат натрия и нитрат натрия. Определить формулы сложных эфиров, написать уравнения реакций и указать условия их протекания.
Составьте уравнения реакций по схеме:
А реакция замещения > В реакция соединения > С реакция замещения > D реакция обмена > Е
Составьте уравнения реакций по схеме:
Cu → CuSO4 → Cu(OH)2 → Cu2O → CuO
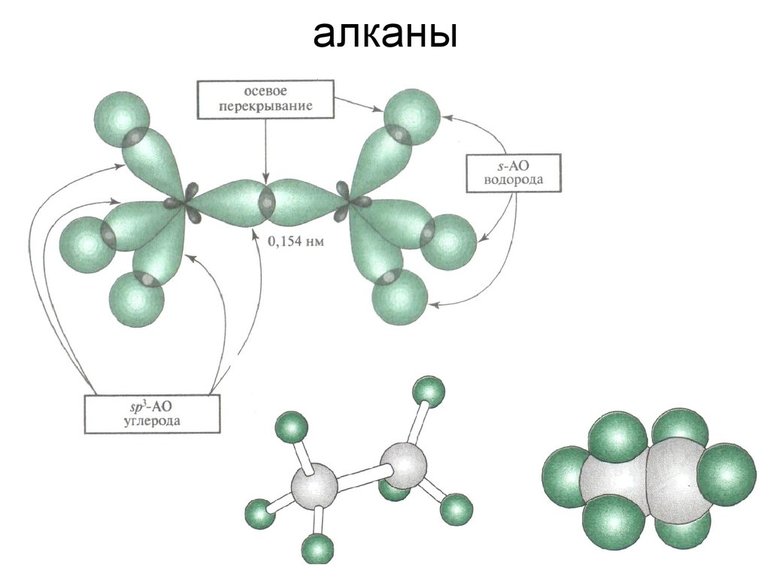
- Под термином раствор обычно подразумевают жидкость, в которой равномерно распределено растворенное вещество. Такая система характеризуется определенным набором свойств. Истинные растворы имеют одинаковый состав в каждой точке объема.
Твердый раствор — система переменного состава, где атомы различных примесных элементов распределены в общей кристаллической решетке основного кристаллического вещества. Твердые растворы способны образовывать все кристаллические вещества. Атомы примеси могут располагаться в основной кристаллической решетке по-разному: упорядоченно и хаотически. Принято считать, что твердые растворы образуются лучше в том случае, если различие радиусов атомов основного и примесного вещества не превышает 15%.
Жидкие кристаллы образуют вещества, имеющие молекулы удлиненной формы. По степени упорядоченности жидкие кристаллы занимают промежуточное положение между жидкостями и твердыми кристаллами. Жидкие кристаллы характеризуются свойствами жидкости — текучестью и твердого кристалла — анизотропией, т.е. зависимостью физических свойств от направления. Другими словами, структура жидкого кристалла легко изменяется при некоторых внешних воздействиях (магнитное или электрическое поле) с изменением свойств. Таким образом, кажущаяся парадоксальность этих терминов на самом деле оборачивается точным обозначением сути явления.
По совокупности свойств, т.е. по поведению в реакциях с кислотами и гидроксидом натрия заключаем: I металл — серебро,(медь не подходит по цвету), металл II — алюминий, металл III — цинк.
Уравнения реакций:
2Al + 6HCl = 2AlCl3 + 3H2
Zn + 2HCl = ZnCl2 + 2H2
Ag + 2HNO3 (конц.) = AgNO3 + NO2 + H2O
Al + HNO3 (конц.) Нет реакции
Zn + 4HNO3 (конц.) + Zn(NO3)2 + 2NO2 + 2H2O
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2
Ответы могут быть различные.
Cu + 2H2SO4 (конц.) → СuSO4 + SO2 + 2H2O
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4
Cu(OH)2 + глюкоза (альдегид) + NaOH → (нагревание)
→ Cu2O + H2O + глюконат натрия (натриевая соль карбоновой кислоты)
2Сu2O + O2 → 4CuO (прокаливание)
Горение углеводорода СxНy описывается схемой реакции:
СxНy + (ч + 0,25у)О2 = хСО2 + 0,5уН2О … + О2остаток
Количество вещества углекислого газа в х раз больше количества вещества исходного углеводорода. Количественные соотношения равны объемным, следовательно, объем углекислого газа в х раз больше объема исходного углеводорода.
Так как сумма объемов углекислого газа и остаточного кислорода составляет 120 мл, то , откуда и .
По условию х не равен единице (…искомый углеводород не является метаном), и не может быть дробным числом, следовательно, .
Воспользуемся еще раз уравнением: 50х + V(О2)ост. = 120
Отсюда объем избыточного кислорода составляет
Реакция замещения в химии — как определить, признаки, примеры уравнений
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
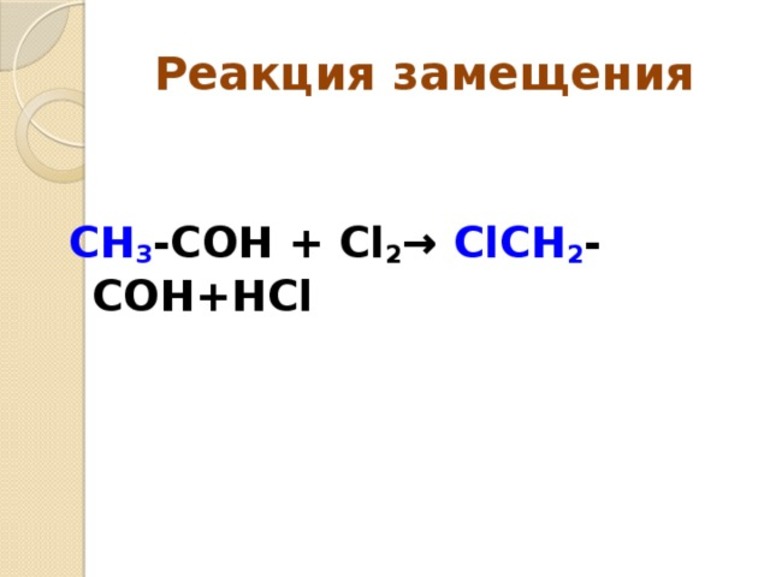
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
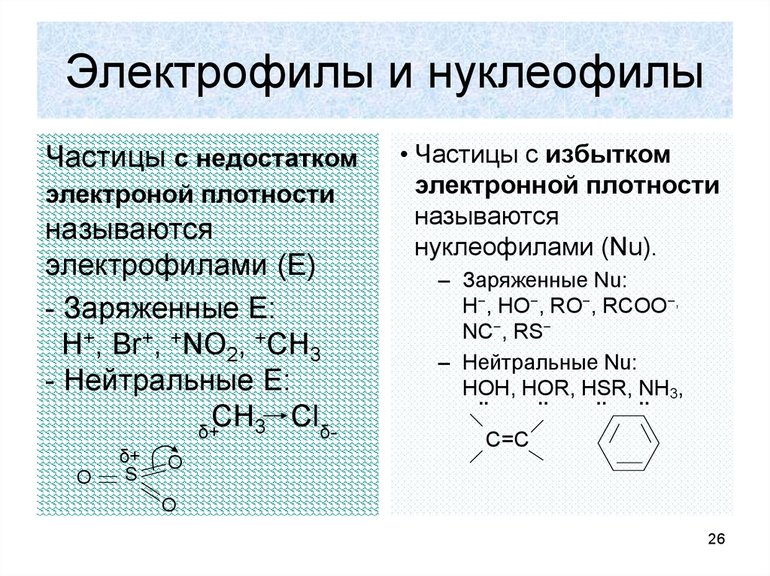
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А12 теста ЕГЭ по химии — «Взаимосвязь неорганических веществ»
Если посмотрите это задание в вариантах ЕГЭ, то там дана схема превращений неорганических веществ и в ответах даны варианты реагентов. Как решать такие задачи?
Темы, которые нужно знать:
Составить уравнения реакций по схеме превращений
На самом деле это не так и сложно. Для этого необходимо знать типы реакций и основные условия их протекания.
1. Химические реакции соединения
- Реакция горения — одна из самых распространенных химических реакций соединения — все вещества горят — и металлы, и неметаллы:
- Химические реакции соединения металла и неметалла — приводят к образованию солей:
(а вот этот момент надо запомнить (или выучить) — железо при взаимодействии с соляной кислотой дает хлорид железа (II), а с хлором — простым веществом — хлорид железа (III))
- Неметаллы также могут взаимодействовать между собой:
2. Составление уравнений реакций по схеме — реакции разложения
- Обычно уравнения реакций разложения солей дают соответствующие основные и кислотные оксиды:
Исключения:
- по-другому разлагаются нитраты — в зависимости от металла, входящего в состав соли. Это можно прочитать >;
- хлорид аммония — NH4Cl — разлагается до аммиака и соляной кислоты: NH4Cl = NH3 + HCl;
- не разлагаются сульфаты
- соли, образованные сильными окислителями:
- Разлагаются некоторые основания:
3. Составление уравнений реакций по схеме — п римеры реакций замещения
- реакция замещения водорода в кислотах:
когда нам дана реакция замещения металлом водорода в кислотах, нужно учитывать электрохимический ряд напряжений металлов: металлы, находящиеся в ряду ДО водорода, вытесняют его из кислот:
2Na + 2HCl = 2NaCl + H2
- реакции замещения в солях:
Ca + 2NaCl = CaCl2 +2 Na
Правило: предыдущий металл вытесняет последующий из его солей
(т.е. реакция Na + CaCl2 не будет идти)
4. Составление уравнений реакций по схеме — р еакции обмена веществ
Здесь следующие правила — обменные реакции идут в сторону образования продуктов при:
- выпадении осадка: NaCl + AgNO3 = AgCl↓ + NaNO3
- выделении газа: Na2CO3 + HCl = NaCl + CO2 + H2O ;
- образовании малодиссоциирующего вещества (H2O, NH4OH, органические кислоты и соли и т.д.): NaOH + H2SO3 = Na2SO3 + H2O
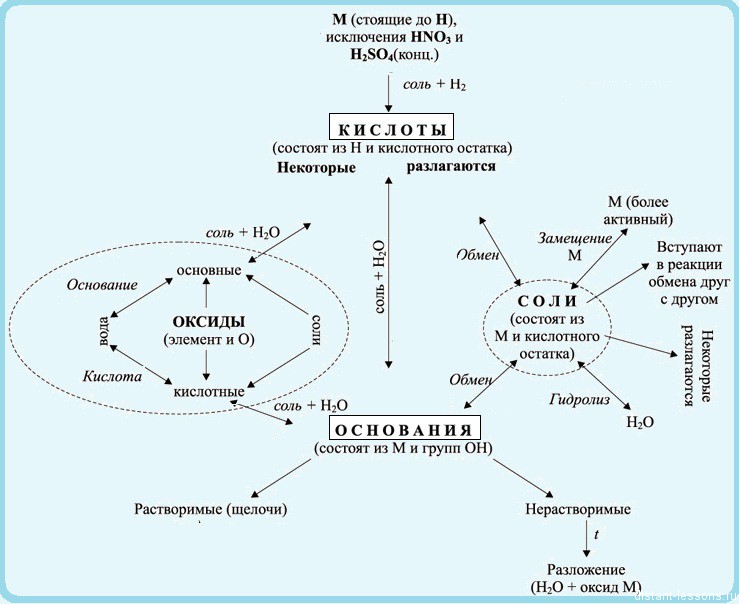
Взаимосвязь неорганических веществ можно отобразить такой таблицей:
Теория, это, конечно, хорошо, но давайте попрактикуемся — попробуем составить уравнения реакций по схемам превращений
В первой реакции к меди можно прибавить либо AgNO3, либо HNO3 — в ряду напряжений медь стоит до серебра, а азотная кислота будет давать окислительно-восстановительную реакцию.
Во второй части схемы нам подходит K2S или H2S, т.к. сульфид меди — осадок.
Ответ: 1)
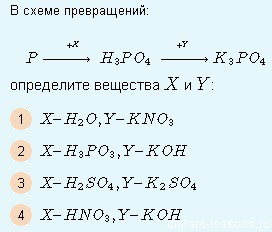
Составим уравнения реакций для данной схемы превращений:
Первая реакция — переход фосфора в фосфорную кислоту — такое под силу только мощным окислителям — либо серной, либо азотной кислоте.
Вторая реакция — обменная — K2SO4 даст растворимые продукты, а вот KOH — в самый раз! Получится вода — малодиссоциирующее вещество.
http://nauka.club/khimiya/reaktsiy-zameshcheniya.html
http://distant-lessons.ru/sostavit-uravneniya-reakcij-po-sxeme-prevrashhenij.html