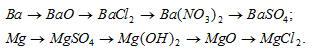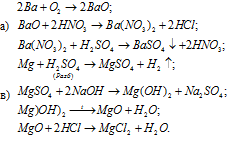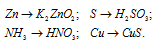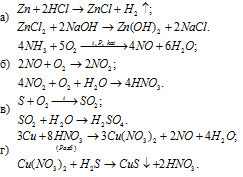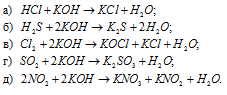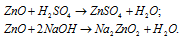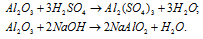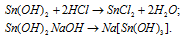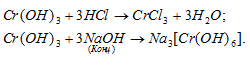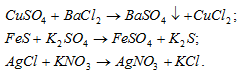Оксид алюминия: получение и свойства
Оксид алюминия
Способы получения
Оксид алюминия можно получить различными методами :
1. Горением алюминия на воздухе:
2. Разложением гидроксида алюминия при нагревании :
3. Оксид алюминия можно получить разложением нитрата алюминия :
Химические свойства
Оксид алюминия — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например , оксид алюминия взаимодействует с оксидом натрия:
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом оксид алюминия проявляет кислотные свойства.
Например , оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например , оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например , оксид алюминия реагирует с серной кислотой:
6. Оксид алюминия проявляет слабые окислительные свойства .
Например , оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
2.2.3. Характерные химические свойства алюминия.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 . Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 o C образуется нитрид алюминия:
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000 о С. В результате этой реакции образуется высокочистое расплавленное железо:
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl 0 + 6Н + = 2Аl 3+ + 3H2 0 ;
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Как решать задачи с участием кислот и оснований
Задача 140.
Написать формулы ангидридов указанных кислот: H2SO4; H3BO3; Н4P2O7; НОСI; HMnO4.
Решение:
Ангидридами кислот называют оксиды, которые при взаимодействии с водой образуют кислоту.
H2SO4 – серная кислота, которой соответствует ангидрид SO3;
H3BO3 – ортоборная кислота, которой соответствует ангидрид B2O3;
H4P2O7 – тетраметафосфорная кислота, которой соответствует ангидрид P2O5;
HOCl – хлорноватистая кислота, которой отвечает ангидрид Cl2O;
HMnO4 – марганцевая кислота, которой отвечает ангидрид Mn2O7.
Задача 141.
Написать формулы оксидов, соответствующих указанным гидроксидам: H2SiО3; Сu(ОН)2; Н3АsО4; Н2WO4; Fе(ОН)3.
Решение:
H2SiО3 – кремниевая кислота, которой соответствует оксид SiO2;
Сu(ОН)2 – гидроксид меди (II), которому соответствует оксид CuO;
Н3АsО4 — мышьяковая кислота, которой соответствует оксид As2O5;
Н2WO4 – вольфрамовая кислота, которой соответствует оксид WO3;
Fе(ОН)3 – гидроксид железа (III), которому соответствует оксид Fe2O3.
Задача 142.
Составить уравнения реакций, с помощью которых можно осуществить указанные превращения:
Решение:
Задача 143.
Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение:
Задача 144.
Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: НСI, Н2S, NO2, N2, С12, СН4, SO2, NH3? Написать уравнения соответствующих реакций.
Решение:
С раствором щёлочи в обычных условиях реагируют следующие газы: НСI, Н2S, NO2, С12, SO2. Азот (N2), метан (СН4) и аммиак (NH3) в обычных условиях не взаимодействуют с раствором buzani.ru/raznoe/stati/1594-klassifikatsiya-neorganicheskikh-veshchestv.
Уравнения реакций:
Задача 145.
Какие соли можно получить, имея в своем распоряжении CuSO4, AgNO3, К3PO4, ВаСI2? Написать уравнения реакций и назвать полученные соли.
Решение:
Имея в своём распоряжении CuSO4, AgNO3, К3PO4, ВаСI2 можно получить следующие соли:
а) При взаимодействии CuSO и К3PO4 образуется нерастворимая соль ортофосфат меди:
б) Реакция CuSO4 с ВаСI2 протекает с выпадением в осадок нерастворимого сульфата меди:
в) при взаимодействии AgNO3 и К3PO4 образуется нерастворимая соль фосфата серебра:
г) При сливании растворов AgNO3 и ВаСI2 выпадает осадок нерастворимого хлорида серебра:
д) При сливании растворов К3PO4 и ВаСI2 выпадает осадок нерастворимого ортофосфата бария:
Таким образом, можно получить следующие нерастворимые соли: Cu3(PO4)2 – ортофосфат меди (II); BaSO4 – сульфат бария; Ag3PO4 – ортофосфат серебра; AgCl – хлорид серебра; Ba3(PO4)2 – ортофосфат бария.
Задача 146.
Назвать следующие соединения: К2О2, МnO2, ВаО2, МnО, СrO3, V2O5.
Решение:
а) К2О2 – пероксид калия;
б) МnO2 — оксид марганца (IV);
в) ВаО2 – пероксид бария;
г) МnО – оксид марганца (II);
д) СrO3 – оксид хрома (VI);
е) V2O5 – оксид ванадия (V).
Задача 147.
Как доказать амфотерный характер ZnO, А12O3, Sn(ОН)2, Cr(ОН)3?
Решение:
а) ZnO – оксид цинка – амфотерный оксид, который реагирует с кислотами, образуя соль и воду, с основаниями – цинкаты.
б) А12O3 – оксид алюминия – амфотерный оксид, который реагирует с кислотами с образованием соли и воды, с основаниями – алюминаты.
в) Sn(ОН)2 – гидроксид олова (II) – амфотерный гидроксид, который реагирует с кислотами, образуя соль и воду, с основаниями – тригидроксостаннаты (II).
г) Cr(ОН)3 – гидроксид хрома (III) амфотерный гидроксид, который реагирует с кислотами, образуя соль и воду, с концентрированным раствором NaOH – гексагидроксохроматы (III).
Задача 148.
Можно ли осуществить в растворах указанные ниже реакции:
Решение:
а) Хлорид бария и другие его растворимые соли являются качественными реактивами на обнаружение ионов SO4 2– В результате реакции выпадает осадок нерастворимого сульфата бария:
б) Сульфид железа нерастворимая соль, поэтому при приливании к нему раствора сульфата калия реакция не идёт. Потому что в растворе находятся только ионы K + и SO4 2- , которые образуются при диссоциации сульфата калия, как сильного электролита:
Ионы K + и SO4 2- не связываются с ионами воды H + , OH — и молекулами FeS – реакция не идёт.
в) AgCl – нерастворимая соль, поэтому при приливании к ней раствора KNO3 реакция не идёт. Потому что в растворе находятся только ионы K + и NO3 — , которые образуются при диссоциации сильного электролита нитрата калия:
Ионы K + и NO3 — не связываются с ионами воды H + , OH — и молекулами AgCl – реакция не идёт.
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-aljuminija
http://buzani.ru/zadachi/khimiya-glinka/1091-osnovaniya-i-kisloty-zadachi-328-372