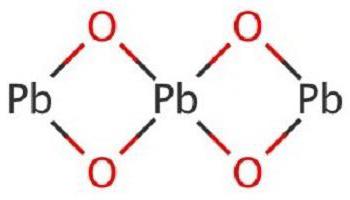
Реакция взаимодействия свинца и кислорода
Реакция взаимодействия свинца и кислорода
Уравнение реакции взаимодействия свинца и кислорода:
Реакция взаимодействия свинца и кислорода.
В результате реакции образуется оксид свинца (II).
Реакция протекает при условии: при температуре 600 °C.
Формула поиска по сайту: 2Pb + O2 → 2PbO.
Реакция взаимодействия гидрокарбоната калия и гидроксида калия
Реакция взаимодействия нитрата скандия и фтороводорода
Реакция взаимодействия карбоната цинка и гидроксида натрия
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Напиши уравнение реакции взаимодействия свинца с кислородом?
Химия | 5 — 9 классы
Напиши уравнение реакции взаимодействия свинца с кислородом.
Рассчитай, чему равна сумма коэффициентов в уравнении реакции и введи её в качестве ответа.
Сумма коэффициентов = 2 + 1 + 2 = 5.
Напиши уравнение реакции взаимодействия оксида серы(VI) с водой?
Напиши уравнение реакции взаимодействия оксида серы(VI) с водой.
Рассчитай, чему равна сумма коэффициентов в уравнении реакции и введи её в качестве ответа.
Напишите уравнение реакции взаимодействия алюминия с кислородом?
Напишите уравнение реакции взаимодействия алюминия с кислородом.
Ответ дайте в виде суммы коэффициентов в уравнении реакции : 1) 10.
H3PO3 + KMnO4 = Чему равна сумма коэффициентов в молекулярном уравнении реакции?
H3PO3 + KMnO4 = Чему равна сумма коэффициентов в молекулярном уравнении реакции.
Сумма коэффициента уравнении реакции горения метана CH4 в кислороде равна?
Сумма коэффициента уравнении реакции горения метана CH4 в кислороде равна.
Сумма коэффициентов в полном ионном уравнении реакции между нитратом свинца(2) и сульфидом натрия равна?
Сумма коэффициентов в полном ионном уравнении реакции между нитратом свинца(2) и сульфидом натрия равна.
Напиши уравнение реакции взаимодействия оксида кальция с водой?
Напиши уравнение реакции взаимодействия оксида кальция с водой.
Рассчитай, чему равна сумма коэффициентов в уравнении реакции и введи её в качестве ответа.
Fe(OH)2 + 2HCl = FeCl2 + 2H2O Вычисли, чему равна сумма коэффициентов в уравнении этой химической реакции, и введи её в качестве ответа ?
Fe(OH)2 + 2HCl = FeCl2 + 2H2O Вычисли, чему равна сумма коэффициентов в уравнении этой химической реакции, и введи её в качестве ответа :
Напиши уравнение реакции взаимодействия оксида калия с водой?
Напиши уравнение реакции взаимодействия оксида калия с водой.
Рассчитай, чему равна сумма коэффициентов в уравнении реакции.
Составь уравнение химической реакций, протекающей при взаимодействии кремния с магнием?
Составь уравнение химической реакций, протекающей при взаимодействии кремния с магнием.
Вычисли, чему равна сумма коэффициентов в уравнении реакции, и введи её в качестве ответа.
Составь уравнение химической реакций, протекающей при взаимодействии раскалённого марганца с парами воды?
Составь уравнение химической реакций, протекающей при взаимодействии раскалённого марганца с парами воды.
Вычисли, чему равна сумма коэффициентов в уравнении реакции, и введи её в качестве ответа.
На странице вопроса Напиши уравнение реакции взаимодействия свинца с кислородом? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
На фото все решение, Na2S + KOH не реагируют.
Оксид свинца: формула, свойства, метод получения
В этой статье мы разберемся с тем, что собой представляет оксид свинца, покажем его формулу, рассмотрим химические и физические характеристики, а также не забудем рассказать о способах его получения. В общем, эта статья понравится тем, кто хочет или уже разбирается в химии. Ведь свинец встречается повсеместно. Если вы до сих пор не знаете область его применения, то прочитайте статью, чтобы понять весь потенциал этого химического элемента таблицы Менделеева.
Способы его получения
Изначально разберемся, как называется оксид свинца. Он традиционно именуется окисью свинца и представляют собой группу бинарных веществ, образованных элементами металла свинца и неметалла кислорода. Существует шесть основных форм PbO: PbO2, PbO, Pb12O19, Pb12O17, Pb3O4. Каждая из них имеет свои особенности строения молекулы, способы получения и область применения. Самые распространенные формы — это оксид свинца (II) и (IV).
Физические характеристики
Оксид свинца, формула которого PbO, может находиться в двухвидовых модификациях: высоко- и низкотемпературных. Переходы от высокотемпературной формы к низкотемпературной происходят медленнее, чем в обратном порядке. Вследствие этого элемент может пребывать в метастабильности при комнатной температуре, а в процессе растирания изменять модификационную форму.
Испарение протекает конгруэнтно, чаще всего в формах Pb2O2 и Pb4O4. Также данная группа оксидов является полупроводником. По типу проводимости, в зависимости от состава, но не превышая пределы гомогенности, оксиды бывают дырочными и электронными. По цвету они обычно бывают желтыми, красными и черными.
Химические особенности и свойства
Растворение хорошо протекает в азотной и кислородной кислотах, ухудшается растворимость в серной и соляной кислоте, так как образуются PbC12 и PbSO4, которые слаборастворимы. При растворении в щелочной среде образуются гексагидроксоплюмбаты (Na2[Pb(OH)4]). Они являются сильными окислителями, некоторые из них могут проявлять свойства амфотеров — окисляться и поглощать другие вещества. Все они способны окисляться до различных состояний, например, на открытом воздухе PbO при температуре 370 градусов перейдет в состояние молекулы Pb12O17, при 540 градусах образуется Pb3O4, а в водородной (H2) и монооксид углеродной (СО) среде вновь образуется металл путем восстановления.
Оксид свинца II
PbO является неорганическим соединением, которое в воде растворяется плохо. Это бинарное вещество в виде кристаллов красного или желтого цвета. В данном соединении свинец проявляет вторую валентность, соответствуя постоянной валентности кислорода. Встречается в природе с примесями, например, в массикоте или свинцовом глёте.
Как получить оксид свинца в промышленности? Его получают путем пропускания кислорода через свинец, нагретый до температуры 600 градусов (2Pb+O2—2PbO), путем нагревания гидроксида свинца при температурах около 100-145 градусов (Pb(OH)2—PbO+CO2), разложением нитратов (2Pb(NO3)2—2Pb+4NO2+O2), прогреванием карбоната свинца (PbCO3—PbO+CO2), разложением диоксидов свинца (2PbO2—PbO+O2) и окислением сульфидов свинца (2PbS+3O2—2PbO+2SO2).
По своим свойствам PbO (II) способен образовать кристаллы в двух модификационных вариантах, которые устойчивы при 489 градусах и выше.
Альфа модификация (свинцовый углет) представляет собой кристаллы красного цвета тетрагональной сингонии, имеют пространственную группу P 4/nmm. Показатель растворимости в воде — α 0,279 22 . Бета модификация (массикот) проявляет метастабильность при комнатных температурах, имеет желтый цвет, кристаллическую форму, ромбическую сингонию, пространственную группу P bcm. Показатель растворимости в воде — β 0,513 22 г/100 мл.
Оксид свинца может проявлять свойства амфотеров при взаимодействии с кислотами (PbO+2HCl—PbCl2+H2O), щелочами (PbO+2NaOH—(400градусов)Na2PbO2+H2O). Способен окисляться, взаимодействуя с кислородом до Pb3O4, а в водной суспензии бромом окисляется до диоксида свинца PbO2. Восстановление до металла происходит при участии оксида углерода, водорода и алюминия. В состоянии влажности поглощает диоксид углерода, образуя при этом основные соли.
Оксид свинца IV
Оксид свинца 4, он же диоксид свинца, имеет формулу PbO2. Является оксидом высших степеней. Как и другие соединения свинца с кислородом является бинарным веществом. Это порошок тёмно-коричневого цвета, довольно тяжелый, которому присущ запах озона. Раньше его можно было встретить под названием пероксид, или перекись свинца.
Добывают PbO2 в промышленности при помощи обработки азотной кислотой сурика свинца, после чего проводится промывка, помещение в вакуум и сушка: Pb3O4+4HNO3—PbO2+2Pb(NO3)2+2H2O.
Температура плавления данного соединения равна 290 градусов, плотность составляет 9.38г/ см³, молярная масса — 239,1988г/моль. Диоксид свинца 4 является очень сильным окислителем, способен вытеснять из концентрированной соляной кислоты хлор в результате нагревания (PbO2+4HCl—PbCl2+Cl2+2H2O). Соли марганца (II) также поддаются окислению до перманганата (5PbO2+2MnSO4+3H2SO4—5PbSO4+2HMnO4+2H2O). Является весьма токсичным веществом.
Применение
Области применения диоксидов свинца самые разнообразные. Оксид свинца 4 находит свое применение, выполняя функцию сиккативов (маслянистых веществ, необходимых для ускорения процесса засыхания красок), катализатора (вещества, необходимого для ускорения протекания химических реакций между соединениями, которые при этом не входят в конечный состав продуктов любых протекающих реакций) и окислителя (вещества, в состав которого входят атомы, способные присоединять к себе свободные электроны в процессе химической реакции, окислитель также можно назвать акцептором).
PbO2 широко используется в свинцово-сернокислотных аккумуляторах, в роли положительных электронных масс в гальванических элементах. Часто, но в малых количествах может применяться как покрытие для электродов, чтобы улучшить электролизный процесс. Диоксид свинца 2 используют при изготовлении суриков, PbO2 можно встретить в аккумуляторах. Оксид свинца широко используется в области изготовления свинцовых стёкол и глазурей. Pb3O4 можно встретить в свинцовых аккумуляторах в качестве замазки и как пигмент для красок против коррозии. Большинство оксидов свинца используют при изготовлении радиотехники, резинотехнической продукции. Также незаменимы они в процессе добычи свинцовых солей при химическом синтезе.
http://himia.my-dict.ru/q/4606253_napisi-uravnenie-reakcii-vzaimodejstvia-svinca-s/
http://www.syl.ru/article/297107/oksid-svintsa-formula-svoystva-metod-polucheniya