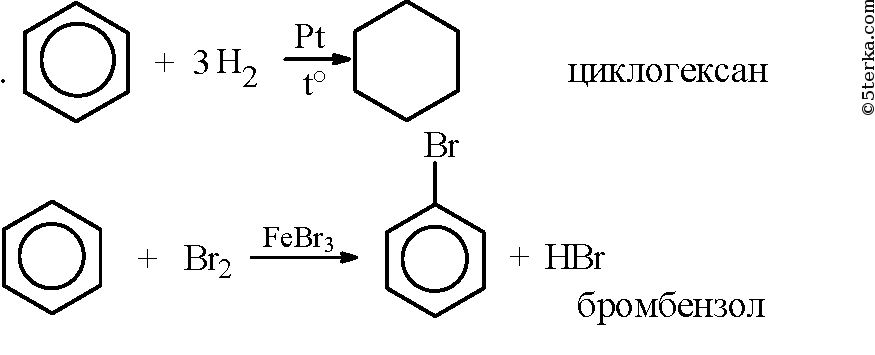
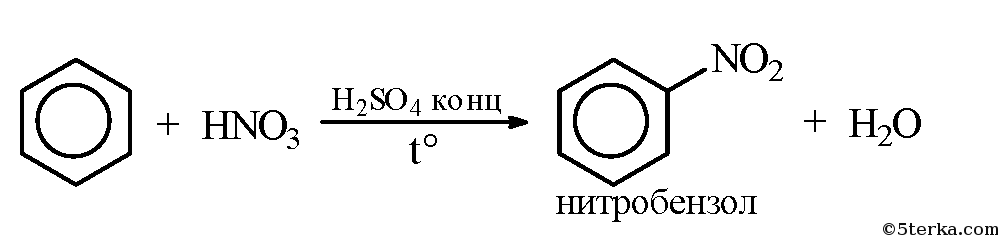
1. Составьте уравнения реакций взаимодействия бензола с водородом, бромом, азотной кислотой. Укажите условия протекания реакций и назовите образовавшиеся вещества.
1. Составьте уравнения реакций взаимодействия бензола с водородом, бромом, азотной кислотой. Укажите условия протекания реакций и назовите образовавшиеся вещества.

задача №1
к главе «Тема IV. Ароматические углеводороды (арены). Работа 1 Номенклатура, изомерия и химические свойства аренов. Вариант 1».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Соединения брома
Бромоводород (НBr)
Способы получения бромоводорода
- из бромидов вытеснением НВr из его соли ортофосфорной кислотой:
- гидролизом галогенидов неметаллов:
- восстановлением свободных галогенов в водных растворах
Химические свойства бромоводорода
НВr по физическим и химическим свойствам сходен с HCl, однако молекула НВr менее устойчива, чем HCl.
Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
- Бромоводород – сильный восстановитель и взаимодействует с окислителями — соединениями марганца, хрома (VI), концентрированной серной кислотой и др:
- Качественная реакция на бромид-ионы – взаимодействие с растворимыми солями серебра. При этом образуется осадок бромида серебра – бледно-желтого цвета:
Кислородные кислоты и окислы брома
Бромноватистая кислота (HBrO)
HBrO — слабая неустойчивая кислота. В свободном виде не выделена. Максимально полученная концентрация HBrO в водном растворе — 30 %.
Ее соли и сложные эфиры называют гипобромитами.
Получение бромноватистой кислоты
HBrO получается при диспропорционировании брома в воде. Присутствие оксида ртути (II) смещает равновесие в сторону кислоты:
В полученном растворе концентрация бромноватистой кислоты не более 6 %.
Химические свойства бромноватистой кислоты
- Разлагается при комнатной температуре:
В темноте также при нагревании выше 60ºС:
3HBrO = HBrO3 + 2HBr
- Нейтрализуется щелочами:
HBrO + NaOH = NaBrO + H2O
- HBrO является сильным окислителем:
Бромистая кислота (HBrO2)
Бромистая кислота HBrO2 —неустойчивое соединение, существует только в водных растворах. Разлагается в течение 4 часов.
Образует соли — бромиты, например бромит бария Ba(BrO2)2•H2O.
Бромноватая кислота (HBrO3)
Бромноватая кислота HBrO3 — бесцветная (или слегка желтоватая) жидкость. В свободном состоянии не выделена, существует в растворе с максимальной концентрацией до 50%. Является сильной кислотой.
Получение бромноватой кислоты
- Окисление бромахлором в горячей воде:
- Взаимодействие брома с раствором бромата серебра:
- Гидролиз пентафторида брома:
- Обменными реакциями между броматами и сильными кислотами:
Химические свойства бромноватой кислоты
- При нагревании выше 100ºС разлагается:
- Взаимодействует с щелочами с образованием броматов:
- Проявляет свойства сильного окислителя:
Cоли бромноватой кислоты – броматы
Наиболее важными являются броматы калия и натрия – это белые вещества, хорошо растворимые в воде. Являются окислителями и слабыми восстановителями
Получение броматов
- Получают при взаимодействии хлора и брома с горячим раствором щелочи:
- При электролизе водного раствора бромида натрия:
- При растворении брома в концентрированном горячем растворе щелочи:
Химические свойства броматов
- Разлагаются при температуре выше 400ºС:
- Свойства окислителя:
Бромная кислота (HBrO4)
Бромная кислота HBrO4 — сильная кислота. Cуществует только в водном растворе с максимальной концентрацией 83%. В свободном виде не выделена, устойчива в растворе с концентрацией менее 55%.
Соли кислоты — перброматы.
Получение бромной кислоты
- Окисление бромноватой кислоты дифторидом ксенона:
- Окисление броматов фтором с последующей обработкой кислотой:
NaBrO3 + F2 + 2NaOH = NaBrO4 + 2NaF + H2O
Химические свойства бромной кислоты
- Бромная кислотаразлагается при нагревании или при комнатной температуре при повышении ее концентрации:
- Как кислота реагирует с щелочами:
- Бромная кислота проявляет свойства сильного окислителя:
Соли бромной кислоты – перброматы
Наиболее выжный – пербромат калия. Белое вещество, умеренно растворимое в воде.
Получение перброматов
- При взаимодействии броматов со фтором в щелочной среде:
- При электролизе водных растворов броматов:
Химические свойства перброматов
- Не разлагаются кислотами и щелочами.
- При нагревании разлагается:
- Являются медленными окислителями:
Оксиды брома
Известны оксиды брома — Вr2O, ВrO2 и Вr3O8, которые крайне неустойчивы.
Ни одно из кислородных соединений брома не нашло важного практического применения
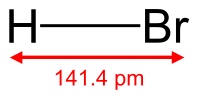
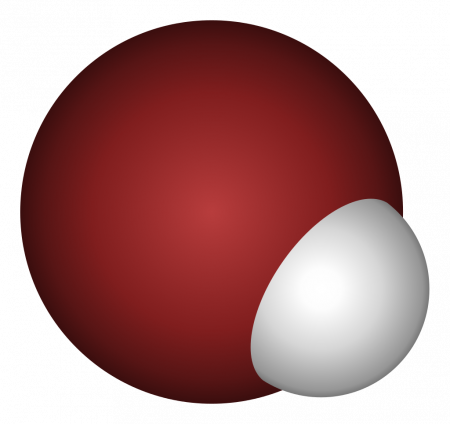
Бромоводород
| Бромоводород | |||
|---|---|---|---|
| |||
| Систематическое наименование | бромоводород | ||
| Традиционные названия | Бромистый водород | ||
| Хим. формула | HBr | ||
| Рац. формула | HBr | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 80,91 г/моль | ||
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | ||
| Энергия ионизации | 11,62 ± 0,01 эВ | ||
| Температура | |||
| • плавления | –86.80 °C | ||
| • кипения | –66.38 °C | ||
| Критическая точка | 90,0 °C, 8,54 МПа | ||
| Энтальпия | |||
| • образования | -34,1 кДж/моль | ||
| Давление пара | 20 ± 1 атм , 20,003 бар , 26,5 бар и 40,7 бар | ||
| Константа диссоциации кислоты pKa | ≈ –9 | ||
| Растворимость | |||
| • в воде | 193 (20 °C) | ||
| Дипольный момент | 0,24 Д | ||
| Рег. номер CAS | 10035-10-6 | ||
| PubChem | 260 | ||
| Рег. номер EINECS | 233-113-0 | ||
| SMILES | |||
| RTECS | MW3850000 | ||
| ChEBI | 47266 | ||
| Номер ООН | 1048 | ||
| ChemSpider | 255 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Транспортировка
- 6 Токсичность
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
http://zadachi-po-khimii.ru/neorganicheskaya-ximiya/soedineniya-broma.html
http://chem.ru/bromovodorod.html