Современная форма уравнения полимолекулярной адсорбции изложена в теории
В большинстве случаев реальная поверхность твердого тела не вполне однородна энергетически; адсорбция, как правило, не является строго локализованной; адсорбированные молекулы практически всегда взаимодействуют между собой; наконец, стехиометрия может нарушаться, вследствие чего адсорбция не будет ограничена образованием одного слоя. Поэтому реальные изотермы адсорбции всегда отклоняются от изотермы Ленгмюра. Еще самим Ленгмюром было показано, что если адсорбционные центры считать энергетически неоднородными, то суммарная адсорбция на всех центрах будет выражена следующим уравнением:
где i — количество групп одинаковых центров.
Брунауэр, Эммет и Теллер отказались от второго допущения Ленгмюра, приводящего к мономолекулярной адсорбции. Для случая, когда температура адсорбтива ниже критической (то есть, это еще пар) они разработали теорию полимолекулярной адсорбции. После анализа многочисленных реальных изотерм адсорбции ими была предложена их классификация на основе выделения пяти основных типов изотерм.
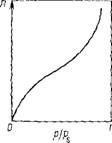
Изотермы типа I отражают мономолекулярную адсорбцию. Изотермы типа II и III обычно связывают с образованием при адсорбции многих слоев, то есть, с полимолекулярной адсорбцией. Приче м, в случае II взаимодействие адсорбент — адсорбат сильнее взаимодействия адсорбат — адсорбат, а в случае III — наобор от. Изотермы типа IV и V отличаются тем, что для них характерна конечная адсорбция при приближении давления пара к давлению насыщения ps. Изотермы типа II и III характерны для адсорбции на не пористом адсорбенте, а типа IV и V — на пористом твердом теле. Все пять типов изотерм адсорбции описываются теорией полимолекулярной адсорбции “БЭТ”, названной так по начальным буквам фамилий ее авторов.
Теория БЭТ сохраняет ленгмюровские представления о динамическом характере адсорбции. Адсорбция считается полислойной. Молекулы первого слоя адсорбируются на поверхности адсорбента в результате межмолекулярного взаимодействия адсорбент — адсорбат. Каждая адсорбированная молекула первого адсорбционного слоя может, в свою очередь, являться центром адсорбции молекул второго слоя и т.д. Так формируются второй и последующие сорбционные слои. Теплота адсорбции в первом слое q1 определяется взаимодействием адсорбат — адсорбент, во всех последующих слоях — взаимодействием адсорбат — адсорбат. Поэтому теплота адсорбции во всех слоях, начиная со второго, равна теплоте конденсации λ. Второй и последующие адсорбционные слои могут начинать образовываться и при незавершенном первом слое, как это показано на рисунке:
Составив уравнение адсорбционного равновесия для каждого слоя и просуммировав их, авторы теории БЭТ получили уравнение для полислойной адсорбции:
В приведенном уравнении АМ — емкость монослоя, С — константа, равная е (q1− λ) / RT . При малых относительных давлениях, когда р как частный случай уравнения БЭТ. В случаях, когда q1 > λ , т.е. энергия взаимодействия адсорбент — адсорбат больше энергии взаимодействия адсорбат — адсорбат, изотерма адсорбции выпукла и относится к типу II или IV. Если же энергия взаимодействия адсорбат — адсорбат больше теплоты адсорбции ( λ > q1 ), то изотерма адсорбции вогнута и относится к типу III или V.
Уравнение изотермы адсорбции БЭТ широко используется для определения величины удельной поверхности адсорбентов. Изотерма адсорбции выражается прямой линией, отсекающей на оси ординат отрезок, равный 1 / АМ С , а тангенс угла ее наклона к оси абсцисс равен (С − 1) / АМ С.
Из этих значений можно найти величину АМ, а зная ее, рассчитать по уравнению удельную поверхность адсорбента. Стандартной методикой для определения удельной поверхности адсорбентов принято считать измерение изотермы адсорбции азота при 77 К. В этом случае wо = 0.162 нм 2 .
- Источник: Пальтиель Л.Р., Зенин Г.С., Волынец Н.Ф. КОЛЛОИДНАЯ ХИМИЯ: Учеб. пособие. – СПб: СЗТУ, 2004. – 68 с.
- Источник: Кукушкина И.И., Митрофанов А.Ю. Коллоидная химия, Кемерово:2009 — 185 с.
Лако-красочные материалы — производство
Технологии и оборудование для изготовления красок, ЛКМ
Теория полимолекулярной адсорбции БЭТ
Уравнение Ленгмюра можно использовать только при условии, что адсорбция вещества сопровождается образованием мономолекулярного слоя. Это условие выполняется достаточно строго при хемосорбции, физической адсорбции газов при небольших давлениях и температурах выше критической (в отсутствие конденсации на поверхности адсорбента), а также при адсорбции из растворов. Указанное ограничение для применения уравнения Ленгмюра связано не столько с формальным описанием адсорбции, сколько с невозможностью получить правильные значения параметров К и А^, соответствующих их физическому смыслу.
В большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и влияние поверхностных сил может распространяться па второй, третий и последующие адсорбционные слои. Эта возможность реализуется, когда газы и пары адсорбируются при температурах ниже критической. В этом случае образуются полимолекулярные слои вещества на поверхности адсорбента. Полимолекулярную адсорбцию можно представить как результат вынужденной конденсации пара под действием поверхностных сил. Если в области образования мономолекулярного слоя величина адсорбции существенно замедляет свой рост с увеличением давления пара, то в области давлений, близкой к давлению насыщенного пара, она резко начинает
Рис. Ш.6. Изотерма полнмолекулярной адсорбции
Возрастать и адсорбция заканчивается объемной конденсацией пар:-) при P = Ps (рис. III.6J.
Первые попытки получения уравнения изотермы полимолекулярной адсорбции были сделаны еще Ленгмюром. Современная форма уравнения полнмолекулярной адсорбции — основного уравнения обобщенной теории Ленгмюра — была предложена лишь примерно двадцать лет спустя Брунауэром, Эмме- гом и Теллером. В соответствии с начальными буквами фамилий авторов обсуждаемая теория получила название теории БЭТ. В этой теории дополнительным допущением к тем, которые были положены в основу вывода уравнения изотермы Ленгмюра, является представление об образовании на поверхности адсорбента «последовательных комплексов» адсорбционных центров с одной, двумя, тремя и т. д. молекулами адсорбата. Тогда процесс адсорбции можно представить в виде последовательных квазихимических реакций:
А + В ^ АЁГ: ХВ + В АВ2: АВ2 + В ^ АВ3 и т. д.
Константы равновесия этих реакций соответственно равны IABJ,, |ДВ2| ^ (АВ3 ]
Где А о—концентрация свободных адсорбционных центров.
Из представленных уравнений получаются следующие выражения для концентрации соответствующих комплексов на поверхности адсорбента:
Авторы теории БЭТ приняли, что во всех слоях, кроме первого, взаимодействуют между собой в основном молекулы адсорбата, как и при конденсации. Поэтому было принято, что
Д’, =/С2= … =/cL=fl„;/fl„ = i/Ps H1J.29V
Где Ki. — константа конденсации пара, равная отношению активностей вещества в жидком состоянии аж и в состоянии насыщенного пара а„, принято йж = 1 (стандартное состояние), а а„=р…
Для упрощения вывода и вида конечного уравнения полимолекулярной адсорбции введем обозначения:
Постоянная С равна отношению констант равновесия адсорбции (мономолекулярной) и конденсации пара. Логарифми рование этого отношения приводит к разности логарифмов констант, а из этого следует, что постоянная С характеризует разность энергий Гиббса процессов адсорбции и конденсации, т. е. энергию Гиббса чистой адсорбции:
Учитывая уравнения (III.29) и (III.30), получим из уравнения (III.28).
Общее число активных центров на адсорбенте, или емкость монослоя, будет равна
Л«=Л0+[АВ] + [АВ21 + [АВ31+ … =
= Л0 + Л0СХ + Л0С. Ї2 + Л0СЛ-3 + …= = Д0[1 + Сл:(1+.Ї + .Ї2+ …1]
Теория полимолекулярной адсорбции
В большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и поэтому остается возможность влияния поверхностных сил на второй, третий и последующие адсорбционные слои. Эта возможность реализуется, когда газы и пары адсорбируются при температуре ниже критической, т.е. образуются полимолекулярные слои вещества на поверхности адсорбента, что можно представить как вынужденную конденсацию пара под действием поверхностных сил. В результате, если в области образования мономолекулярного слоя величина адсорбции существенно замедляет свой рост с увеличением давления пара, то в области давлений, близкой к давлению насыщенного пара, она резко начинает возрастать и адсорбция заканчивается объемной конденсацией пара при 
В этой теории процесс адсорбции представляется в виде последовательных квазихимических реакций:
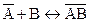


Константы равновесия этих реакций

Из этого уравнения можно получить выражение для концентраций соответствующих комплексов на поверхности адсорбента

Авторы теории приняли, что во всех слоях, кроме первого, взаимодействие такое же, как и при конденсации, так как взаимодействуют между собой в основном молекулы адсорбата. Поэтому было принято, что

где 


Для упрощения вида и вывода конечного уравнения полимолекулярной адсорбции введем обозначения:


Учитывая уравнения (5.18) и (5.17), получаем из уравнения (5.16):

Общее число активных центров на адсорбенте, или емкость монослоя:

Ряд в круглых скобках является геометрической прогрессией с суммой 1/(1–x) при условии x
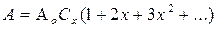
Ряд 


Подставляя значение 

Соотношение (5.24) является основным уравнением обобщенной теории Лангмюра и называется уравнением полимолекулярной адсорбции БЭТ.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Измерение адсорбции уксусной кислоты на поверхности активированного угля
Цель работы
1. Наблюдать адсорбцию на границе жидкой и твердой фаз.
2. Построить изотерму адсорбции.
3. Определить значения постоянных параметра K и n в уравнении Фрейндлиха.
Реактивы и оборудование
1. Уксусная кислота, 1 Н раствор.
2. Гидроксид натрия, 0,1 Н раствор.
3. Соляная кислота, 0,1 Н раствор.
4. Фенолфталеин, спиртовый раствор.
5. Уголь активированный.
Порядок выполнения работы
1. Определяют точную концентрацию раствора гидроксида натрия. Для этого отбирают в три колбы аликвоты раствора гидроксида натрия по 10 мл, доводят дистиллированной водой до объема приблизительно 100 мл и титруют 0,1 Н раствором соляной кислоты в присутствии фенолфталеина до перехода окраски из малиновой в бесцветную. Рассчитывают концентрацию гидроксида натрия по среднему объему соляной кислоты, использованной на титрование.
2. Определяют точную концентрацию исходного раствора уксусной кислоты. Для этого отбирают 100 мл уксусной кислоты (
1 Н) и титруют гидроксидом натрия в присутствии фенолфталеина. Рассчитывают концентрацию уксусной кислоты с учетом концентрации гидроксида натрия, определенной в пункте 1.
3. Разбавлением 1Н раствора уксусной кислоты приготавливают в шести колбах, к которым имеются пробки, растворы как указано в табл. 5.1. Для этого в мерную колбу на 100 мл вводят пипеткой указанное количество 1 Н уксусной кислоты и доводят объем до метки дистиллированной водой. Затем приготовленный раствор переносят в колбу емкостью 250 мл с пробкой. Так готовят шесть растворов. Приготовление начинают с наименее концентрированного раствора.
Приготовление растворов уксусной кислоты
| Номер колбы | ||||||
| Объем 1 Н раствора, мл | 1,2 | 2,5 | ||||
| Нормальность, моль/л | 0,012 | 0,025 | 0,05 | 0,1 | 0,2 | 0,4 |
4. В каждую колбу помещают 3 г активированного угля (6 таблеток). Колбы закрывают пробками и взбалтывают в течение 10 минут. Затем растворы фильтруют в чистые сухие колбы. В фильтрате точное содержание уксусной кислоты определяют титрованием 0,1 Н раствором гидроксида натрия, используя в качестве индикатора фенолфталеин.
5. Результаты эксперимента заносят в табл. 5.2.
| Номер колбы |
| Нормальность исходного раствора N0, моль/л |
| Нормальность раствора после адсорбции Nк, моль/л |
| Величина сорбции А,ммоль/г |
| ln А |
| ln Nк |
N0 определяется с учетом исходной концентрации уксусной кислоты до разбавления, определенной в пункте 2.
Nк определяется в пункте 4.
Величина сорбции рассчитывается по формуле

где V – объем раствора, мл;
m – масса сорбента, г.
6. Построить изотерму сорбции в координатах А – Nк. Определить вид полученной изотермы.
Построить линейную зависимость ln А – ln Nк. Обработав данную зависимость методом наименьших квадратов определить значения постоянных параметра K и n в уравнении Фрейндлиха.
Сделать выводы по работе.
Вопросы для контроля
1. Адсорбция, адсорбент, адсорбат, десорбция.
2. Механизмы адсорбции.
3. Адсорбция на твердой поверхности: изотермы Генри, Ленгмюра, Фрейндлиха, полимолекулярная адсорбция.
Лабораторная работа №6
ИОНООБМЕННАЯ АДСОРБЦИЯ
Ионообменная адсорбция. Иониты
Ионообменная адсорбция из растворов наблюдается на поверхностях с достаточно выраженным двойным электрическим слоем. Подвижные противоионы электрического слоя способны обмениваться на другие ионы того же знака, находящиеся в растворе.
Вещества, проявляющие способность к ионному обмену и используемые для адсорбции ионов, получили название ионообменников или ионитов.
Иониты имеют структуру в виде каркаса, «сшитого» обычно ковалентными связями. Каркас (матрица) обладает положительными или отрицательными зарядами, которые скомпенсированы противоположным зарядом подвижных ионов – противоионов, находящихся в адсорбционной и диффузной частях электрического слоя. Противоионы могут заменяться на другие ионы с зарядом того же знака. Каркас выступает в роли полииона и обусловливает нерастворимость ионита в растворителях.
Иониты классифицируют по происхождению на природные и синтетические; по составу – на неорганические и органические; по знаку заряда обменивающихся ионов – на катиониты, аниониты и амфолиты (последние в зависимости от условий могут обмениваться как катионами, так и анионами).
К природным неорганическим ионитам относят кристаллические силикаты. Их каркас представляет собой правильную сетчатую структуру алюмосиликата, в порах которой располагаются ионы щелочных или щелочноземельных металлов, выступающие в роли противоионов. Природными ионитами органического происхождения являются, например, гумусовые вещества, молекулы которых содержат карбоксильную группу, способную к ионному обмену. Составляющие почву вещества обладают амфотерными свойствами и поэтому могут обменивать как катионы, так и анионы. Природные иониты не нашли широкого технического применения, так как имеют ряд недостатков, в частности, они химически нестойки, не обладают достаточной механической прочностью.
Первыми синтетическими ионитами были плавленные и гелеобразные пермутиты – алюмосиликаты, подобные природным цеолитам. Из неорганических синтетических анионитов, имеющих практическое значение, можно назвать гели гидроксидов алюминия и железа. Для специальных целей применяются гидроксиды циркония, хрома, олова, свинца и др. Все неорганические иониты разрушаются под действием кислот и щелочей. В качестве ионитов используют различные углеродсодержащие вещества (каменные угли, дерево, торф), обработанные концентрированными растворами серной, хлорсульфоновой, фосфорной и других кислот. Широкое распространение получили синтетические иониты на основе органических смол благодаря их хорошей способности поглощать ионы и высокой химической стойкости. Ионообменные смолы – это нерастворимые гели-полиэлектролиты с ограниченной способностью к набуханию [4].
http://kraska.biz/poverxnostnye-yavleniya-i-dispersnye-sistemy/teoriya-polimolekulyarnoj-adsorbcii-bet/
http://allrefrs.ru/5-7782.html