Спектр атома водорода описывается уравнением бора
§3 Постулаты Бора
К 1913 г. имелись три экспериментальных факта, которые не находили объяснения в рамках классической физики:
- Эмпирические закономерности линейчатого спектра атома водорода, выраженные в формуле Бальмера – Ридберга.
- Ядерная модель атома Резерфорда.
- Квантовый характер излучения и поглощения света (тепловое излучение и фотоэффект).
Для возможности разрешения возникших затруднений Н. Бор (датский ученый) сформулировал три постулата для водорода и водородоподобных атомов – ядром с зарядом Ze и один электрон движется вокруг ядра.
I – й постулат – постулат стационарных состояний:
В системе существуют некоторые стационарные состояния, не изменяющиеся во времени без внешних воздействий. В этих состояниях атом не излучает света.

В стационарном состоянии атома электрон, двигаясь по круговой орбите с ускорением, не излучает света, должен иметь дискретные (квантованные) значения момента импульса
III – й постулат – правило орбит:
Излучение испускается или поглощается в виде светового кванта энергии при переходе электрона из одного стационарного состояния в другое.
Величина светового кванта равна разности энергий стационарных состояний, между которыми совершается переход электрона


Набор возможных дискретных частот
Квантовых переходов и определяют линейчатый спектр атома.
§4 Опыты Франка и Герца
Первый и третий постулаты Бора были экспериментально подтверждены в опытах Франка и Герца (немецкие ученые) в 1913 г.

13 Па) содержала катод (К), две сетки (С1 и С2) и анод (А). Электроны, испускаемые катодом ускорялись разностью потенциалов, приложенной между К и С1. Между сеткой С2 и А приложен небольшой задерживающий потенциал 0,5 В. Электроны, ускоренные в области, где испытывают соударения с атомами ртути. Электроны, которые имеют после соударения достаточную энергию для преодоления задерживающего потенциала в области 3 (по рисунку), достигают анода. При неупругих соударениях электронов с атомами ртути последние могут возбуждаться. Согласно теории Бора, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. (Основное состояние n = 1, возбужденное — n = 2, 3, 4,…) Поэтому, если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний.
Из опыта следует, что при увеличении ускоряющего потенциала до 4,86 В анодный ток возрастает монотонно. Пройдя при U = 4,86 В через максимум, анодный ток резко падает. Затем опять возрастает при изменении U = 4,86 ÷ 2·4,86 В. При U = 2·4,86 В падает и затем опять возрастает и т.д.

Атом ртути, переходя в основное состояние, испускает свет с λ = 255 нм (УФ), который и был обнаружен в опыте. Таким образом, опыт Франка и Герца подтвердил I и III – й постулаты Бора.
§5 Спектр атома водорода по Бору
При движении электрона по орбите сила Кулона является центростремительной. Тогда
По II – му постулату Бора
Радиус первой боровской орбиты равен
Внутренняя энергия атома равна сумме кинетической и потенциальной энергии

Подставив в формулу выражение для r , получим разрешенные значения энергии:

где знак минус означает, что электрон находится в связанном состоянии. Из формулы (1) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n . Целое число n в (1), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n =1 является основным состоянием. Состояние с n > 1 называется возбужденным. Энергетический уровень, соответствующий основному состоянию, называется основным, все остальные – возбужденными.
Ионизация атома – отрыв электрона от атома. Энергия ионизации атома водорода равна 13,6 эВ.
Согласно II – му постулату Бора при переходе атома водорода из стационарного состояния n в стационарное состояние m ( n > m ) испускается квант с энергией
— формула Бальмера – Ридберга,
где 
Теория Бора внутренне противоречива: применяет законы классической физики, а основывается на квантовых постулатах. Теория Бора не может объяснить спектр атома гелия.
Тема 15. Теория Бора для атома водорода. Спектр атома водорода
Постулаты Бора. Первый постулат:в атоме существуют стационарные (не изменяющиеся со временем) состояния, находясь в которых атом не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, на которых находятся электроны. В стационарном состоянии атома для электрона на круговой орбите значения момента импульса могут принимать только определенный набор дискретных значений, удовлетворяющих условию:
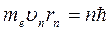
me –масса электрона, υn – скорость электрона на n-ой орбите радиуса rn,
n – номер орбиты, ħ = h/2 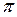
Радиус n-ой орбиты для атома водорода: 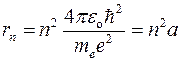
где e – заряд электрона, εo – электрическая постоянная,
а – радиус первой орбиты ( n = 1), называемый первым боровским радиусом.
Второй постулат:при переходе электрона с одной стационарной орбиты на другую излучается (или поглощается) один фотон с энергией hν, равной разности энергий соответствующих стационарных состояний En и Еm :
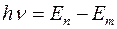
При переходе атома из состояния большей энергии в состояние меньшей энергии происходит излучение фотона, а при поглощении фотона происходит переход атома из состояния меньшей энергии в состояние большей энергии.
Дискретность набора значений энергии стационарных состояний En и Еm предопределяет дискретность набора возможных частот ν квантовых переходов между этими состояниями, что обусловливает линейчатость спектра атома.
По теории Бора полная энергия электрона на n-ой орбите атома водорода:
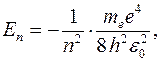
Из приведенной формулы следует, что энергетические состояния атома образуют последовательность уровней, энергия которых изменяется в зависимости от значения числа n , называемое главным квантовым числом. Энергетическое состояние с n = 1 является основнымсостоянием, а состояния с n >1 являются возбужденными состояниями.
Согласно второму постулату Бора, при переходе атома водорода из состояния n в состояние т с меньшей энергией испускается фотон с энергией hν :
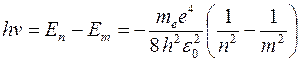
откуда частота ν квантового перехода в спектре испускания атома водорода:
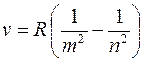
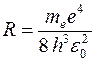
Числа m (m = 1, 2, 3 …) и n (n = m + 1, m + 2, m + 3, …) определяют номера электронных орбит в атоме, между которыми происходит квантовый переход.
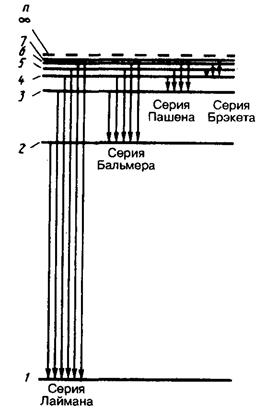
Приведенная формула описывает серии линий в спектре испускания атома водорода (рис. 31), где m определяет серию (m = 1, 2, 3…), а n определяет отдельные линии соответствующей серии (n = m + 1, m + 2, m + 3, …).
Спектр испускания атома водорода.
В ультрафиолетовой области спектра атома водорода наблюдается
серия Лаймана (m = 1): 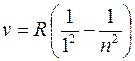
В видимой области спектра атома водорода наблюдается
серия Бальмера (m = 2): 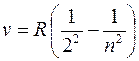
В инфракрасной области спектра атома водорода наблюдаются:
серия Пашена (m = 3): 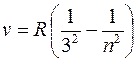
серия Брэкета (m = 4): 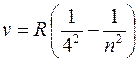
серия Пфунда (m = 5): 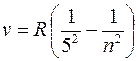
серия Хэмфри (m = 6): 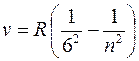
Таким образом, квантовая теория атома, созданная Бором, позволила описать экспериментально наблюдаемые атомные спектры поглощения и испускания.
Вопросы к экзамену
по второй части двухсеместрового курса физики
(Электричество и магнетизм. Волновая и квантовая оптика)
1. Теорема Остроградского — Гаусса для электростатического поля.
2. Напряженность. Работа сил электростатического поля. Потенциал. Связь между потенциалом и напряженностью электростатического поля.
3. Магнитное поле. Закон Био-Савара-Лапласа. Индукция линейного и кругового тока.
4. Действие магнитного поля на проводник с током (закон Ампера) и на движущийся заряд (сила Лоренца).
5. Магнитный поток. Теорема Гаусса для магнитного поля. Явление электромагнитной индукции.
6. Электромагнитные колебания. Колебательный контур. Уравнение свободных незатухающих гармонических колебаний.
7. Электромагнитные колебания. Колебательный контур. Уравнение свободных затухающих гармонических колебаний.
8. Электромагнитные волны. Вектор Умова-Пойнтинга.
9. Волновая теория света. Интерференция света. Метод Юнга.
10. Дифракция света. Принцип Гюйгенса-Френеля. Метод зон Френеля. Дифракция Френеля на круглом отверстии и на диске.
11. Дифракция света. Дифракция Фраунгофера на дифракционной решетке.
12. Дисперсия и поляризация света. Закон Малюса.
13. Корпускулярная теория света. Фотоэффект и эффект Комптона.
14. Тепловое излучение. Закон Кирхгофа. Закон Стефана-Больцмана. Закон смещения Вина. Квантовая гипотеза Планка.
15. Теория Бора для атома водорода. Постулаты Бора. Спектр атома водорода.
Атом Бора.
Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев.
Темы кодификатора ЕГЭ: постулаты Бора.
Планетарная модель атома, успешно истолковав результаты опытов по рассеянию -частиц, в свою очередь столкнулась с очень серьёзными трудностями.
Как мы знаем, любой заряд, движущийся с ускорением, излучает электромагнитные волны. Это — неоспоримый факт классической электродинамики Максвелла, подтверждаемый многочисленными наблюдениями.
Нам также хорошо известно, что электромагнитные волны несут энергию. Стало быть, ускоренно движущийся заряд, излучая, теряет энергию, которая этим излучением уносится.
А теперь давайте возьмём произвольный электрон в планетарной модели. Он двигается вокруг ядра по замкнутой орбите, так что направление его скорости постоянно меняется. Следовательно, электрон всё время имеет некоторое ускорение (например, при равномерном движении по окружности это будет центростремительное ускорение), и поэтому должен непрерывно излучать электромагнитные волны. Расходуя свою энергию на излучение, электрон будет постепенно приближаться к ядру; в конце концов, исчерпав запас своей энергии полностью, электрон упадёт на ядро.
Если исходить из того, что механика Ньютона и электродинамика Максвелла работают внутри атома, и провести соответствующие вычисления, то получается весьма озадачивающий результат: расход энергии электрона на излучение (с последующим падением электрона на ядро) потребует совсем малого времени — порядка секунды. За это время атом должен полностью «коллапсировать» и прекратить своё существование.
Таким образом, классическая физика предрекает неустойчивость атомов, устроенных согласно планетарной модели. Этот вывод находится в глубоком противоречии с опытом: ведь на самом деле ничего такого не наблюдается. Предметы нашего мира вполне устойчивы и не коллапсируют на глазах! Атом может сколь угодно долго пребывать в невозбуждённом состоянии, не излучая при этом электромагнитные волны.
Постулаты Бора.
Оставалось признать, что внутри атомов перестают действовать известные законы классической физики. Микромир подчиняется совсем другим законам.
Первый прорыв в познании законов микромира принадлежит великому датскому физику Нильсу Бору. Он предложил три постулата, резко расходящиеся с механикой и электродинамикой, но тем не менее позволяющих правильно описать простейший из атомов — атом водорода.
Классическая физика хорошо описывает непрерывные процессы — движение материальной точки, изменение состояния идеального газа, распространение электромагнитных волн. . . Энергия объекта, подчиняющегося механике или электродинамике, в принципе может принимать любые значения. Однако линейчатые спектры указывают на дискретность процессов, происходящих внутри атомов. Эта дискретность должна фигурировать в законах новой теории.
Первый постулат Бора. Всякий атом (и вообще, всякая атомная система) может находиться не во всех состояниях с любым, наперёд заданным значением энергии. Возможен лишь дискретный набор избранных состояний, называемых стационарными, в которых энергия атома принимает значения Находясь в стационарном состоянии, атом не излучает электромагнитные волны.
Как видим, первый постулат Бора вопиющим образом противоречит классической физике: налагается запрет на любые значения энергии, кроме избранного прерывистого набора, и признаётся, что электроны, вроде бы движущиеся ускоренно, на самом деле не излучают.
Выглядит фантастически, не правда ли? Однако в том же 1913 году, когда Бор предложил свои постулаты, существование стационарных состояний было подтверждено экспериментально — в специально поставленном опыте немецких физиков Франка и Герца. Таким образом, стационарные состояния — это не выдумка, а объективная реальность.
Значения разрешённого набора называются уровнями энергии атома. Что происходит при переходе с одного уровня энергии на другой?
Второй постулат Бора. Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией , то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией
Эта же формула работает и при поглощении света: в результате столкновения с фотоном атом переходит из состояния в состояние с большей энергией , а фотон при этом исчезает.
Для примера на рис. 1 показано излучение фотона при переходе атома с энергетического уровня на уровень . Переход заключается в том, что электрон «соскакивает» с одной орбиты на другую, расположенную ближе к ядру.
Рис. 1. Излучение фотона атомом
Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми.
В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии разрешённого дискретного набора ; соответственно, набор этих частот также получается дискретным. Вот почему спектр излучения атомов состоит из отдельно расположенных резких ярких линий.
Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия которого в точности равна разности каких-то двух разрешённых значений энергии и . Переходя в состояние с более высокой энергией , атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние . Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии.
Качественного объяснения характера атомных спектров, однако, недостаточно. Хотелось бы иметь теорию, позволяющую вычислить частоты наблюдаемых спектров. Бору удалось это сделать в самом простом случае — для атома водорода.
Атом водорода.
Атом водорода состоит из ядра с зарядом , которое называется протоном, и одного электрона с зарядом (через обозначена абсолютная величина заряда электрона). При построении своей теории атома водорода Бор сделал три дополнительных предположения.
1. Прежде всего, мы ограничиваемся рассмотрением только круговых орбит электрона. Таким образом, электрон движется вокруг протона по окружности радиуса с постоянной по модулю скоростью (рис. 2 ).
Рис. 2. Модель атома водорода
2. Величина , равная произведению импульса электрона на радиус орбиты , называется моментом импульса электрона. В каких единицах измеряется момент импульса?
Это в точности размерность постоянной Планка! Именно здесь Бор увидел появление дискретности, необходимой для квантового описания атома водорода.
Правило квантования (третий постулат Бора). Момент импульса электрона может принимать лишь дискретный набор значений, кратных «перечёркнутой» постоянной Планка:
3. Выше мы говорили, что классическая физика перестаёт работать внутри атома. Так оно в действительности и есть, но вопреки этому мы предполагаем, что электрон притягивается к протону с силой, вычисляемой по закону Кулона, а движение электрона подчиняется второму закону Ньютона:
Эти три предположения позволяют довольно просто получить формулы для уровней энергии атома водорода. Переписываем соотношение (3) в виде:
Из правила квантования (2) выражаем :
и подставляем это в (4) :
Отсюда получаем формулу для допустимых радиусов орбит электрона:
Теперь перейдём к нахождению энергии электрона. Потенциальная энергия кулоновского взаимодействия электрона с ядром равна:
(Она отрицательна, так как отсчитывается от бесконечно удалённой точки, в которой достигает максимального значения.)
Полная энергия электрона равна сумме его кинетической и потенциальной энергий:
Вместо подставим правую часть выражения (4) :
Полная энергия, как видим, отрицательна. Если на радиус орбиты никаких ограничений не накладывается, как это имеет место в классической физике, то энергия может принимать любые по модулю значения. Но согласно (5) существует лишь дискретный набор возможных значений радиуса; подставляя их в (6) , получаем соответствующий набор допустимых значений энергии атома водорода:
Основное состояние атома водорода — это состояние с наименьшей энергией . В основном состоянии атом может находиться неограниченно долго. Вычисление даёт:
Мы видим, что если атом находится в основном состоянии, то для выбивания электрона нужно сообщить атому энергию, равную как минимум 13,6 эВ. Эта величина носит название энергии ионизации атома водорода.
По формуле (5) легко вычислить радиус орбиты основного состояния:
То есть, диаметр атома оказывается равным как раз см — величине, известной из опыта. Таким образом, теория Бора впервые смогла объяснить размер атома!
Кроме того, в рамках теории Бора удаётся получить формулы для вычисления частот (или длин волн) спектра атома водорода. Так, согласно второму постулату Бора и формуле (7) имеем:
На практике чаще имеют дело с длинами волн. Учитывая, что , формулу (8) можно переписать так:
Константа м называется постоянной Ридберга. Теория Бора даёт значение этой постоянной, очень хорошо согласующееся с экспериментом.
Длины волн спектра атома водорода образуют серии, характеризующиеся фиксированным значением в формуле (9) . Все длины волн данной серии излучаются при переходах на уровень с вышележащих энергетических уровней .
Переходы в основное состояние:
образуют серию Лаймана. Длины волн этой серии описываются формулой (9) при :
Линии серии Лаймана лежат в ультрафиолетовом диапазоне.
Переходы на второй уровень:
образуют серию Бальмера. Длины волн этой серии подчиняются формуле (9) при :
Первые четыре линии серии Бальмера лежат в видимом диапазоне (рис. 3 ), остальные — в ультрафиолетовом.
Рис. 3. Видимый спектр атома водорода (серия Бальмера)
Переходы на третий уровень:
образуют серию Пашена.Длины волн этой серии описываются формулой (9) при :
Все линии серии Пашена лежат в инфракрасном диапазоне.
Имеются ещё три «именованных» серии: это серия Брэккета (переходы на уровень ), серия Пфунда (переходы на уровень ) и серия Хэмпфри (переходы на уровень ). Все линии этих серий лежат в далёкой инфракрасной области.
Достоинства и недостатки теории Бора.
О достоинствах модели атома водорода, предложенной Бором, мы так или иначе уже сказали. Резюмируем их.
-Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы.
Для микромира характерно квантование — дискретность изменения величин, описывающих состояние объекта. В качестве меры квантования, как показала теория Бора, может выступать постоянная Планка , которая является универсальной константой и играет фундаментальную роль во всей физике микромира (а не только в явлениях излучения и поглощения света).
-Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира.
-В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы.
Однако теория Бора, разумеется, не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков.
-Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы — второй закон Ньютона и закон Кулона — используются для записи уравнения движения электрона по круговой орбите.
-Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы.
-Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой , построенной десятилетием позже — в 1920-х годах.
http://helpiks.org/4-67319.html
http://ege-study.ru/ru/ege/materialy/fizika/atom-bora/