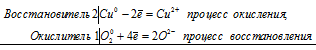Сплав меди с цинком – как называется и чем хорош?
Многокомпонентный либо двойной сплав меди с цинком, как известно очень многим, называется латунью. В таком сплаве ключевую роль играет цинк. Кроме того, в нем имеются добавки железа, свинца, никеля, марганца и других элементов.
1 Что собой представляет сплав цинка и меди, как он называется?
Латунь, речь о которой пойдет в данной статье, характеризуется превосходной стойкостью против коррозии и высоким показателем прочности. Это отличает ее от многих других металлов, а также непосредственно от меди. В атмосферных условиях латуни имеют величину коррозионной стойкости среднюю между медью и цинком.
Описываемые сплавы славятся своими уникальными технологическими характеристиками, что позволяет применять их для изготовления всевозможных легко формуемых и обрабатываемых изделий со сравнительно небольшими геометрическими размерами.
Любая латунь идеально подходит для производства отливок (это обусловлено незначительной склонностью сплава к ликвации и прекрасной его текучестью). Также из латуни разных марок получаются замечательные полуфабрикаты катаного типа – проволока, полосы, листы, разнообразные профильные изделия, ленты. Процесс производства подобных полуфабрикатов очень прост, так как сплавы на основе цинка и меди без проблем поддаются деформации, которая называется пластической.
Латунь может содержать цинка от 5 до 45 процентов (существуют сплавы и с большим содержанием этого химического элемента, но они применяются крайне редко в практической деятельности человека). В тех случаях, когда концентрация цинка в сплаве составляет от 20 до 36 процентов, латуни называют желтыми, 5–20 процентов – красными (иначе – томпак).
Теплопроводность меди по своей величине выше, чем у латуни (аналогично обстоит ситуация и с показателем электропроводности). Кроме того, медь дороже латуни. Понятно, что экономически целесообразнее использовать сплавы, а не чистые медные материалы, так как между собой по ряду технологических, механических и антифрикционных характеристик они практически ничем не отличаются.
2 Двухкомпонентная и многокомпонентная латунь
Разделение интересующих нас сплавов на красный (томпак) и желтый – это не единственный вариант их классификации. Латуни, кроме того, делят на двух- и многокомпонентные. Двухкомпонентные включают в свой состав медь (ее всегда больше) и цинк, а также совсем немного иных включений. Томпак – яркий представитель таких композиций. В нем цинка всегда не больше 10 процентов, а концентрация меди может достигать 97 процентов (минимум – 88).
Латунь с двумя компонентами изменяет свои свойства в зависимости от того, какой фазовый состав она имеет. Существуют одно- и двухфазные сплавы. Первые имеют структуру, когда в меди присутствует раствор (твердый) цинка. В данном случае латуни проявляют высокую степень пластичности. А вот двухфазные комбинации, в которых цинка содержится более 39 процентов, описываются недостаточной пластичностью, но при этом они намного более прочные.
Однофазные сплавы легко обрабатываются давлением. Их форму за счет пластичности латуни можно изменять не только при высоких, но и при низких температурах. При этом есть один нюанс. Он заключается в том, что при температурах от 300 до 700 градусов томпак или другую латунь (одно- либо двухфазную) деформировать запрещается, так как в данном интервале в сплаве присутствует зона хрупкости.
Многокомпонентные композиции (как правило, их именуют специальными) включают в себя ряд других легирующих компонентов кроме цинка и меди. Обычно многокомпонентная латунь содержит следующие элементы:
- никель — он вводится для увеличения коррозионной стойкости сплавов и их прочностных показателей;
- олово — легирующий компонент, который увеличивает сопротивляемость изделий из латуни ржавлению в соленой воде (например, в море) и их прочность;
- кремний — элемент, повышающий антифрикционные возможности сплава цинка с медью, но одновременно ухудшающий их прочность и твердость;
- свинец — его добавка в латунь обеспечивает легкость ее обработки при помощи режущих инструментов, но, к сожалению, при этом наблюдается снижение механических возможностей сплава;
- марганец — легирование латуни марганцем обеспечивает высокую стойкость композиции к коррозии и отличную прочность (эффект от внесения этого элемента становится более ощутимым, если вместе с марганцем в сплав вводят олово, алюминий и железо).
Как видим, разные компоненты неодинаково воздействуют на свойства композиции из меди и цинка, будь то томпак или другой сплав, за счет чего можно создавать сплавы с особыми характеристиками.
3 Как маркируется латунь?
Разобраться с маркировкой описываемых сплавов несложно. В простых (двухкомпонентных) латунях на первом месте их марки стоит литера «Л», а затем идет двузначное число. Это число указывает на то, сколько меди содержится в сплаве (данные приводятся в процентах). Таким образом, если мы видим перед собой маркировку Л70, сразу становится понятным, что в данной композиции имеется 70 % меди и 30 % цинка.
Многокомпонентные сплавы имеют чуть более сложную маркировку. После литеры «Л», говорящей потребителю о том, что перед ним именно латунь, а не какой-либо иной состав, ставятся и другие литеры. Под ними зашифрованы легирующие добавки, введенные в сплав. А после этих «буквенных шифров» идут цифры (друг от друга они отделяются дефисами):
- первая (двузначная) определяет содержание в сплаве меди;
- остальные говорят о количестве легирующих компонентов.
Для примера давайте посмотрим на латунь ЛАЖМц66-6-3-2. В ней имеется 66 % меди (первое число после букв), 6 % алюминия (вторая цифра), 3 % железа (третья цифра) и 2 % марганца (четвертая цифра). Сложив друг с другом эти числа, мы получим сумму 77. Это означает, что второго главного компонента в данном сплаве (цинка) содержится 23 % (от 100 отнимаем 77).
Добавим, что литейные латуни, о которых мы расскажем чуть ниже, маркируются иначе. В них после литеры, указывающей на легирующий компонент, сразу ставят цифру, определяющую процентное содержание этого самого компонента в сплаве. То есть, состав сплава, допустим, ЛЦ40Мц1,5 расшифровывается следующим образом:
- цинка – 40 %;
- марганца – 1,5 %;
- остальное – медь.
4 Деформируемые и литейные латуни
Деформируемые сплавы (томпак и другие) характеризуются высокими антифрикционными характеристиками, большой антикоррозионной стойкостью и пластичностью. Кроме того, они очень легко и надежно соединяются со сталью посредством сварки. По этой причине их используют для выпуска различных биметаллических конструкций и изделий. А непосредственно томпак, имеющий благородный золотистый оттенок, применяется для производства всевозможной фурнитуры и художественных элементов (его пайка, как и пайка медных труб, а также других изделий из меди достаточно проста).
Деформируемые марки латуни идут на изготовление:
- конденсаторных труб (ЛМш68-0,05, ЛО60-1, ЛО62-1, ЛО70-1, ЛО90-1, ЛА77-2);
- не поддающихся ржавлению элементов машин (ЛК80-3), речных и морских судов (ЛМцА57-3-1, ЛАЖ60-1-1);
- изделий, производимых резкой (ЛЖС58-1-1);
- втулок, болтов, гаек (ЛС59-1, ЛМц58-2, ЛС60-1);
- матриц для полиграфических комбинатов (ЛС64-2).
Двойные латуни (не томпак) используются для выпуска деталей машин и патрубков с большой толщиной стен (Л60), штампованных деталей (Л68), компонентов химических и теплотехнических агрегатов (Л80, Л90) и других изделий.
Латуни литейного класса за счет своих свойств (высокая жидкотекучесть, отличные технологические и механические показатели, стойкость к коррозии, отсутствие склонности к ликвации) рекомендовано применять для изготовления далее указанных деталей:
- штуцеров автомобильных гидравлических механизмов (ЛЦ25С2);
- подшипников, сепараторов (ЛЦ40С);
- винтов червячной конструкции с большой массой (ЛЦ23А6ЖЗМц2);
- ответственных изделий, функционирующих при температурах в районе +300 градусов (ЛЦ40МцЗЖ);
- стойких к ржавлению изделий (ЛЦЗОАЗ).
2.2.4. Химические свойства переходных металлов (меди, цинка, хрома, железа).
Химические свойства меди
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 вместо предполагаемой формулы 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 . Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(NH3)2]Cl и [Cu(NH3)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400 о С образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400 о С образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 о С может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d 10 4s 2 . Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900 o C (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 , т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 o С порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 o C соответственно):
С бромом же хром реагирует при температуре красного каления (850-900 o C):
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 o С:
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 , то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» H2FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Либо же при избытке серы дисульфид железа:
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =t o => 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =t o => 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =t o => 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Взаимодействие с кислотами-окислителями
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 о С). т.е.:
Соединения меди и ее сплавы
Задание 405
В присутствии влаги и диоксида углерода медь покрывается зеленым налетом. Как называется и каков состав образующегося соединения? Что произойдет, если на него подействовать хлороводородной (соляной) кислотой? Напишите уравнения соответствующих реакций. Окислительно-восстановительную реакцию составьте на основании электронных уравнений.
Решение:
При обычной температуре медь очень слабо взаимодействует с кислородом воздуха в присутствии влаги и диоксида углерода, покрываясь зеленной плёнкой основной соли (основной карбонат меди) (CuOH)2CO3:
2Сu 2+ + О2 0 = 2Cu 2+ + 2О 2-
Если на эту соль подействовать раствором хлороводородной кислотой, то она растворится, и будут выделяться пузырьки газа:
Плёнка зелёного цвета в виде зелёного налёта образуется на медных монетах, пролежавших долго в сыром месте. Очистить монету от зелёного налёта можно, протерев её ваткой, смоченной в растворе соляной кислоте.
Задание 406
Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой — избыток раствора щелочи. Какие соединения цинка и меди образуются при этом? Составьте уравнения соответствующих реакций.
Решение:
Латунь – сплав меди с цинком. При обработке латуни азотной кислотой в реакцию вступят цинк и медь. При этом образуются соответственно Zn(NO3)2, NH4NO3 и Cu(NO3)2, NO:
Если полученный раствор разделить на две части, и к одной из них прибавить избыток раствора аммиака, а к другой – избыток раствора щёлочи, то произойдут следующие реакции:
а) В первом растворе:
Таким образом, в первом растворе образуются растворимые комплексные соли цинка и меди. Комплексная соль [Cu(NH3)4](NO3)2 придаёт раствору ярко-синее окрашивание.
б) Во втором растворе:
Таким образом, во втором растворе образуется синий студёнистый осадок Cu(NO3)2 и белый осадок Zn(OH)2 и будет наблюдаться запах аммиака.
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-perehodnyh-metallov
http://buzani.ru/zadachi/khimiya-shimanovich/990-svojstva-medi-zadaniya-405-406