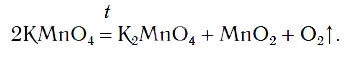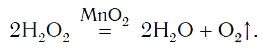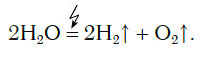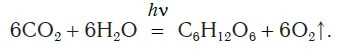Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Урок 17. Получение кислорода
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
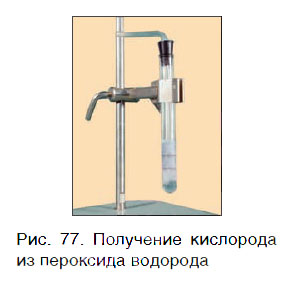
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
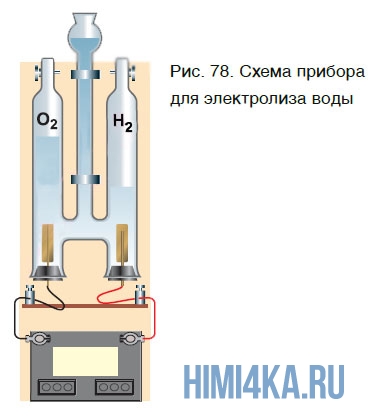
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.
Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Образование кислорода в природе и получение его в технике
Миллионы лет непрерывно происходит потребление кислорода.
Он в огромных количествах расходуется на медленное и быстрое окисление, на горение и взрыв, а состав воздуха остается неизменным, содержание кислорода в нем не уменьшается.
Как же воздух пополняется кислородом?
Еще в конце XVIII века был поставлен опыт, который поможет нам ответить на этот вопрос.
Под стеклянный колпак была помещена зажженная свеча. Некоторое время свеча горела, но вскоре погасла:
кислород воздуха под колпаком был весь израсходован. Время горения свечи было зафиксировано.
Предполагая, что растения играют какую-то роль в образовании кислорода, опыт был повторен. Рядом с зажженной свечой положили пучок мяты. Горящую свечу и мяту накрыли тем же колпаком. Лучи солнечного света, проникая через стекло колпака, падали на растение, освещая его зеленые листья. Прошло много времени — больше, чем в первом опыте, — но свеча не гасла и продолжала гореть обычным пламенем. Так было установлено, что зеленые листья растений изменяют состав воздуха и на свету выделяют кислород. Одновременно было открыто, что растения извлекают из воздуха углекислый газ.
Никто в то время не мог еще объяснить суть этого замечательного явления. Честь открытия роли растений в жизни нашей планеты принадлежит великому русскому ученому Клименту Аркадьевичу Тимирязеву.
Если посмотреть через микроскоп на срез зеленого листа, то в клетках, похожих на пчелиные соты, можно увидеть зеленые зерна — хлоропласты. Их также называют хлорофилловыми зернами. В каждой клеточке листа содержится от 25 до 50 хлорофилловых зерен. Это о ник говорил Тимирязев: «Хлорофилловое зерно — тот фокус, та точка в мировом пространстве, где солнечный луч, превращаясь в химическую энергию, становится источником всей жизни на земле».
Что же происходит в зеленых листьях растений? В листьях имеются многочисленные отверстия — устьица, которые служат растению для дыхания и питания. Через эти устьица из воздуха в листья проникает углекислый газ. Своими корнями растение всасывает влагу из земли и подает ее к листьям по тонким капиллярам ствола и стеблей.
Под влиянием света и тепла солнечных лучей в хлорофилловых зернах листа между водой и углекислотой происходит сложная химическая реакция — фотосинтез. В результате образуются продукты, переходящие в виноградный сахар и кислород.
Виноградный сахар имеет особое название — глюкоза, которое произошло от греческого слова «глюкос», означающего «сладкий».
Молекулы глюкозы состоят из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. На образование 1 молекулы глюкозы необходимо 6 молекул углекислого газа (СO2) и 6 молекул воды (Н2O). При этом должно выделиться 6 молекул кислорода. Следовательно, когда образуется 1 грамм глюкозы, освобождается более 1 грамма, или около 900 кубических сантиметров, чистого кислорода.
Так под влиянием солнечного света и тепла в хлорофилловых зернах растений, живущих на земле и под водой, происходит образование кислорода, которым непрерывно пополняется наша планета.
Растения являются неиссякаемым источником необходимого для жизни кислорода, и их по праву можно назвать «зеленой фабрикой кислорода».
До последнего времени считали, что кислород, который выделяется из растений при фотосинтезе, отщепляется от углекислого газа. Полагали, что в хлорофилловых зернах под действием света происходит расщепление молекулы углекислого газа на кислород и углерод. Углерод, вступая в реакцию с водой, образует, в конечном счете, глюкозу, а кислород выделяется в атмосферу.
В настоящее время существует другая теория. Считают, что в хлорофилловых зернах под действием солнечных лучей происходит распад не молекулы углекислого газа, а молекулы воды. При этом образуется кислород, который выделяется в атмосферу, и водород, который в соединении с углекислым газом дает глюкозу.
Теория эта получила свое экспериментальное подтверждение в 1941 году в опытах А. П. Виноградова, который впервые применил для изучения фотосинтеза тяжелый изотоп кислорода О 18 .
Поливая растение водой, содержащей тяжелый изотоп О 18 , А. П. Виноградов наблюдал, что чем больше тяжелого изотопа кислорода О 18 содержалось в воде, которой поливали растение, тем больше его находили в выделяющемся кислороде.
Если поливать растение обычной водой и поместить его в атмосферу углекислого газа, содержащего тяжелый изотоп кислорода О 18 , то в выделяющемся при фотосинтезе кислороде изотоп О 18 не обнаруживается.
Эти опыты убедительно показали, что при фотосинтезе в зеленых листьях растений кислород получается не за счет углекислого газа, а за счет разложения воды. Водород, входящий в состав воды, вместе с углекислотой идет на образование глюкозы.
Глюкоза в листьях не остается. Она, как растворимое питательное вещество, разносится по всему растению и служит ему пищей и строительным материалом для образования клетчатки. Из клетчатки состоят корни, стволы, стебли и листья растений.
Часть глюкозы превращается в крахмал и откладывается в плодах и зернах.
Для жизни и развития растения необходимы солнечный свет и непрерывное поступление к нему углекислого газа и воды. В процессе питания растения воздух вокруг него обогащается кислородом и обедняется углекислым газом. Благодаря работе ветра воздух перемешивается, и таким образом у листьев растения поддерживается постоянная концентрация углекислого газа.
А как же обеспечивается подача углекислого газа к листьям в жаркую безветренную погоду? В такую погоду молекулы углекислого газа, беспорядочно двигаясь в воздушном пространстве, очутившись около зеленого листа, вдруг резко поворачивают к нему.
Какая сила заставляет их свернуть к листу?
Если наполнить двумя различными газами сосуд, разделенный перегородкой, и затем осторожно вынуть ее, газы перемешаются, образуя однородную смесь. Такое же явление можно наблюдать, если привести в соприкосновение два различных раствора.
Если разделить между собой два различных газа или раствора, поместив между ними перегородку из желатины, кожи или другого мелкопористого материала, можно заметить, как через некоторое время по обеим сторонам перегородки концентрации газов или растворов будут одинаковы.
Процессы самопроизвольного перемешивания газов или жидкостей, а также проникновение их через полупроницаемые перегородки называются диффузией.
Скорость диффузии тем больше, чем больше разница в концентрациях диффундирующих веществ.
Вот почему, как только концентрация углекислого газа у зеленого листа становится меньше, чем на некотором расстоянии от него, воздух около листа пополняется молекулами углекислого газа из близлежащих слоев атмосферы. Их места занимают сотни, тысячи и миллионы молекул углекислого газа из более отдаленных частей пространства.
Одновременно с процессом диффузии углекислого газа идет процесс диффузии кислорода от зеленого листа в более отдаленные пространства, где концентрация его меньше.
Под водой, как и на суше, растения питаются углекислым газом и вырабатывают глюкозу и крахмал, освобождая кислород.
Откуда же берется углекислый газ в воде. Он образуется при дыхании животных и растений, живущих под водой. Кроме того, он попадает туда из воздуха, растворяясь в поверхностных слоях воды. Перемешиванием, или диффузией, углекислый газ проникает вглубь.
Углекислый газ хорошо растворяется в воде. Его растворимость при низких температурах в 35 раз больше растворимости кислорода. В литре воды при температуре 0° и давлении 760 миллиметров растворяется 50 кубических сантиметров кислорода, а углекислого газа — более 1700 кубических сантиметров. Хотя при температуре воды 20° углекислого газа в литре растворится примерно половина от этого количества, но и этого достаточно, чтобы растения, находящиеся под водой, не испытывали недостатка в углекислом газе. На зеленой поверхности подводных растений происходит тот же процесс усвоения углерода, что и на воздухе.
Налейте в стакан обыкновенной водопроводной воды и пропустите через нее углекислый газ. Опустите в воду растение и накройте его воронкой. На узкую часть воронки наденьте пробирку, наполненную водой. Вынесите стакан с растением на солнечный свет. Через несколько часов в пробирке соберется заметное количество газа. Снимите пробирку с узкой части воронки и под водой
Растение, находясь под водой, при питании выделяет кислород.
заткните ее пробкой. Теперь можно вынуть пробирку из воды и опрокинуть ее пробкой вверх. Оставшаяся в пробирке вода опустится на дно, а газ окажется над водой. Откройте пробку. Так как плотность кислорода несколько больше плотности воздуха, кислород некоторое время (пока не продиффундирует в воздух) останется в пробирке. Опустите в пробирку тлеющую лучинку, и вы убедитесь в том, что газ, который выделился из растения, — кислород.
Образующийся в воде кислород равномерно распределяется по всей толще воды, насыщая ее. Если кислорода окажется больше, чем его может раствориться в воде при данной температуре, избыток его уйдет в воздух. Если его будет меньше, то недостающее количество кислорода дополнится из воздуха.
Не совсем верно утверждать, что кислород равномерно распределяется по всей толще воды. На разной глубине вода имеет различную температуру. А мы знаем, что чем выше температура, тем меньше растворится в ней кислорода. Поэтому в разное время года, на различных глубинах концентрация растворенного в воде кислорода различна. В неглубоких водоемах разница в количестве растворенного кислорода в верхних и нижних слоях не очень велика, и ею можно пренебречь.
Растения, живущие на земле или под водой, не только выделяют кислород, но и поглощают его. Как и любой живой организм, растения дышат. Часть кислорода, которая образуется при питании растений, потребляется ими при дыхании.
Если после долгой зимней ночи войти в закрытое помещение, где находилось много цветов, чувствуется такая духота, как будто здесь долгое время находилось много людей. Растения израсходовали часть кислорода воздуха на дыхание, и в помещении образовался избыток углекислого газа.
Итак, кислород в природе совершает непрерывный круг. При дыхании человека, животных и растений, при горении твердого и жидкого топлива кислород расходуется и образуется углекислый газ. Этот газ идет на питание растений, которые возвращают кислород обратно в воздух.
Растения играют важную роль в жизни человека. Они не только кормят и согревают нас — они веками обеспечивают постоянное содержание кислорода в воздухе, без чего невозможна жизнь на Земле.
А не меняется ли содержание кислорода в воздухе зимой, когда остаются зелеными только хвойные деревья?
Зимой количество кислорода, выделяемого растениями, сокращается, но запасы его в атмосфере чрезвычайно велики. Если бы в течение тысячи или даже двух тысяч лет вообще не было никакого возвращения кислорода, а происходило только его потребление, то общее количество израсходованного кислорода не превысило бы 0,1 процента всего запаса кислорода в атмосфере. Запасы кислорода в воздухе неисчислимы.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
http://himi4ka.ru/arhiv-urokov/urok-17-poluchenie-kisloroda.html
http://www.activestudy.info/obrazovanie-kisloroda-v-prirode-i-poluchenie-ego-v-texnike/