Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
- Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
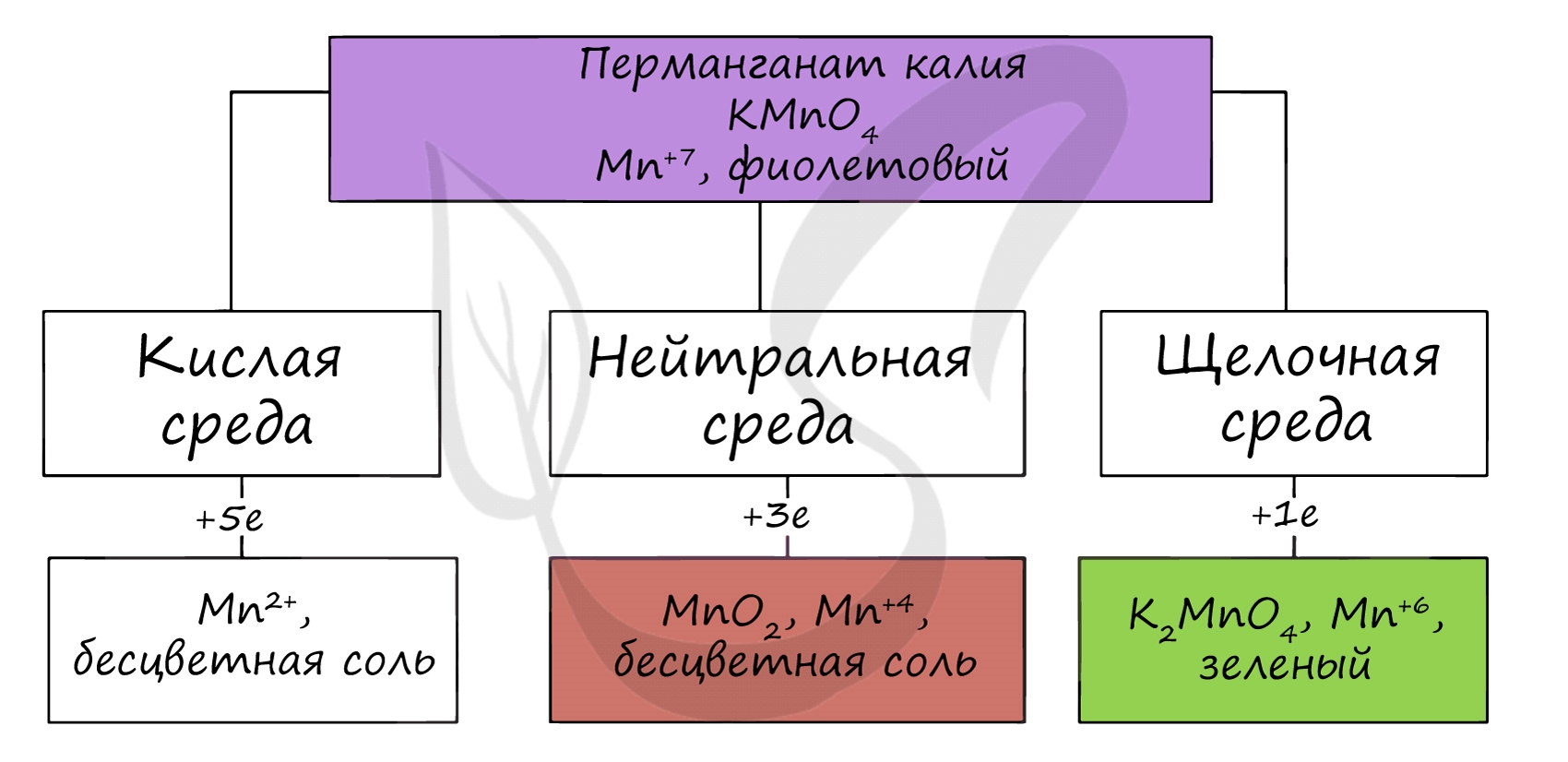
В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
- Реакции с неметаллами (и аммиаком 🙂
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
- Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
Марганец (Mn)
Соединения марганца:
Пиролюзит(минерал марганца) был известен людям еще с древних времен, он использовался нашими предками для осветления стекла, получаемого варкой. До 1774 г. пиролюзит считали разновидностью магнитного железняка. И только в 1774 г. швед К. Шееле догадался, что в пиролюзите присутствует неизвестный тогдашней науке металл, после чего Ю. Ган получил металлический марганец, нагревая пиролюзит в печке с углем. Свое название «марганец» получил в начале 19 века (от немецкого Manganerz — марганцевая руда).
Марганец занимает 14-е место среди всех химических элементов по распространенности в земной коре. Больше всего марганца содержится в основных породах. Самостоятельные месторождения марганца крайне редки, чаще этот металл сопутствует железу во многих его рудах. Достаточно много марганца содержится в железо-марганцевых конкрециях, расположенных в донной части Мирового океана.
Минералы, богатые марганцем:
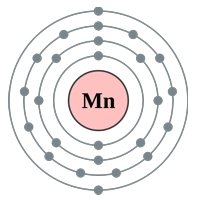
Рис. Строение атома марганца.
Электронная конфигурация атома марганца — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 5 электронов 3d-подуровня (всего 7 электронов), поэтому в соединениях марганец может принимать степени окисления от +7 до +1 (наиболее часто встречаются +7, +2). Марганец является химически активным металлом. Аналогично алюминию при комнатной температуре реагирует с кислордом, содержащимся в атмосферном воздухе, с образованием прочной защитной оксидной пленки, которая предотвращает дальнейшее окисление металла.
Физические свойства марганца:
- металл серебристо-белого цвета;
- твердый;
- хрупкий при н. у.
Известны 4 модификации марганца: α-форма; β-форма; γ-форма; δ-форма.
До 710°C устойчивой является α-форма, которая при дальнейшем нагревании последовательно через все модификации переходит к δ-форме (1137°C).
Химические свойства марганца
- марганец (порошок) легко реагирует с кислородом, образуя оксиды, вид которого зависит от температуры реакции:
- 450°C — MnO2;
- 600°C — Mn2O3;
- 950°C — Mn3O4;
- 1300°C — MnO.
- мелкораздробленный марганец при нагревании реагирует с водой с выделением водорода:
Mn + 2H2O = Mn(OH)2 + H2; - марганец (порошок) при нагревании вступает в реакцию с азотом, углеродом, серой, фосфором:
Mn + S = MnS; - активно реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Mn + 2HCl = MnCl2 + H2; - реагирует с разбавленной азотной кислотой:
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
Применение и получение марганца
- чистый марганец получают электролизом водных растворов MnSO4 с добавкой (NH4)2SO4 при pH=8-8,5: анод — свинец; катод — нержавеющая сталь (чешуйки марганца снимают с катодов);
- менее чистый марганец получают из его оксидов металлотермическими методами:
- алюмотермия:
4Al + 3MnO2 = 3Mn + 2Al2O3; - кремнийтермия:
Si + MnO2 = Mn + SiO2.
- алюмотермия:
- в металлургии марганец используют для связывания серы и кислорода:
Mn + S = MnS; 2Mn + O2 = 2MnO; - в качестве лигирующей добавки при выплавке различных сплавов (марганец дает коррозоустойчивость, вязкость, твердость):
- манганин — сплав марганца с медью и никелем;
- ферромарганец — сплав марганца с железом;
- марганцевая бронза — сплав марганца с медью.
- Калия перманганат издавная используют в качестве антисепитческого средства, которое действует только на поверхности кожи и слизистых оболочек.
Биологическая роль марганца:
Марганец входит в десятку «металлов жизни», необходимых для нормальной жизнедеятельности животных и растительных клеток.
В теле взрослого человека содержится порядка 12 мг марганца, который участвует в образовании белковых комплексов, а также входит в состав некоторых нуклеиновых кислот, аминокислот, ферментов (аргиназы и холинэстеразы).
Марганец наряду с магнием участвует в активации гидролиза АТФ, обеспечивая тем самым энергетическую жизнедеятельность живой клетки.
Ионы марганца участвуют в активации нуклеазы — данный фермент необходим для разложения нуклеиновых кислот до нуклеотидов.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Получение марганца
Получение марганца в производственных масштабах

Для более глубокой очистки используют электролитический способ, иногда получение марганца в лабораторных условиях с помощью восстановления водородом.
Процесс протекает при нагревании оксида марганца, уже при 450°С процесс заметно ускоряется.
Марганец используют главным образом в черной металлургии для производства стали (легирующие добавки). Марганец или его соединения широко применяют также в цветной металлургии (сплавы), электротехнической (двуокись марганца в ряде гальванических элементов), стекольной (для получения бесцветных и окрашенных стекол) и других отраслях промышленности.
В природе марганец встречается исключительно в виде окисленных руд, содержащих более или менее значительное количество железа. Важнейшим минералом марганца в рудах является пиролюзит МnO2. Черная металлургия может использовать марганец в виде ферросплавов и сплавов с кремнием, поэтому большую часть добываемой марганцевой руды перерабатывают на эти продукты.
Металлический марганец получают силикотермическим и алюминотермическим восстановлением пиролюзита. Недостатки этих методов привели к разработке электролитического способа производства марганца, главными достоинствами которого являются как возможность получения весьма чистого металла (до 99,5% Мn), так и возможность переработки бедных марганцевых руд.
При электролитическом способе производства марганца исходную руду обычно подвергают восстановительному обжигу для перевода нерастворимых высших окислов марганца типа МnO2 в низший окисел МnО, а огарок подвергают сернокислотному выщелачиванию с переводом марганца в раствор в виде MnSO 4. Полученный раствор очищают от вредных примесей и направляют на электролиз с нерастворимыми анодами.
Помимо электроэкстракции, получение электролитного марганца возможно также путем электролитического рафинирования металлического марганца, полученного термическим путем. Этот способ не получил широкого применения.
Получение оксида марганца и его выщелачивание
В руде марганец содержится в виде окислов МnO2 и Мn 2O3. Наряду с ними в руде всегда содержится значительное количество окислов железа Fe 2O3 и Fe 3O. И те, и другие практически нерастворимы в разбавленной серной кислоте. Раствор, идущий на электроэкстракцию, не должен содержать растворенного железа, так как последнее осаждается на катоде раньше марганца. Поэтому в качестве сырья применяют маложелезистые руды, а также ведут обжиг при невысоких температурах, не выше 700° С, чтобы не допустить заметного восстановления окислов железа.
При обжиге образуется закись марганца МnО, которая чрезвычайно быстро окисляется на воздухе до высших окислов; поэтому сразу после обжига огарок направляют на выщелачивание. В качестве растворителя, как правило, используют отработанный электролит электролитических ванн. Этот электролит состоит в основном из сульфата аммония (135—180 г/л), серной кислоты (25—40 г/л) и небольшого количества сульфата марганца. Процесс выщелачивания можно выразить следующей реакцией:
Очистка растворов марганца
Растворы после выщелачивания, помимо марганца, содержат некоторые количества железа, меди, свинца, мышьяка, никеля, кобальта, цинка и других примесей. Будучи значительно более электроположительными, чем марганец, они выделяются на катоде даже в случае весьма незначительного их содержания в растворе. Поэтому электролит необходимо тщательно очищать.
Так же, как и при электролизе цинка, первой стадией очистки марганцевого электролита является гидролитическая очистка. Раствор после выщелачивания нейтрализуют аммиаком или избытком огарка до рН = 6,5. При этом сульфаты железа и алюминия, присутствующие в растворе, гидролизуются и дают осадок гидроокисей. Одновременно частично удаляются из раствора за счет адсорбции или образования основных солей ионы мышьяка и молибдена. Гидролиз соли марганца происходит при более высоком значении рН (>8,5), вследствие чего марганец в осадок не выпадает.
После гидролиза электролит очищают от меди, никеля, кобальта и других тяжелых металлов. Для этого раствор обрабатывают газообразным сероводородом или сульфидом аммония. В осадок выделяются сульфиды этих металлов. Осадок отфильтровывают. В фильтрате содержится некоторое количество коллоидальной серы и сульфидов. Чтобы избавиться от этих примесей, в электролит добавляют железный купорос FeSO4 до содержания в растворе 0,1 г/л железа. При рН = 6,5—7,0 железо окисляется кислородом воздуха и выпадает в виде гидроокиси, адсорбируя коллоиды; при этом удаляются также остатки мышьяка и молибдена.
После окончания очистки электролит содержит 30—40 г/л марганца и 135—140 г/л (NH4)2SО4, некоторое количество сульфатов магния и кальция и небольшое количество других примесей (1 — 2г /л).
Получение марганца электролизом

Выделить марганец на катоде из кислой среды поэтому не удается (рис. 2). Повышением рН до величины порядка 8—8,4 равновесный потенциал водорода сдвигается примерно на 0,5 в в отрицательную сторону, и резко снижается ток обмена водорода. Это дает возможность при катодной поляризации электрода выделять на катоде марганец совместно с водородом (кривые 3 и 4).
Получение марганца возможен когда электролит должен быть менее кислым. Однако чрезмерное защелачивание раствора ведет к выделению гидроокиси марганца. Значения рН электролита поддерживают порядка 7,5—8,4, при этом обеспечивается максимальный выход по току без заметного выделения на катоде гидроокиси марганца.
Существенное влияние на качество осадка и выход по току оказывает содержание примесей в электролите. Характер действия примесей при электролизе марганца во многом схож с процессом электроэкстракции цинка. Предельно допустимые содержания (в мг/л) примесей в электролите при наращивании катодного осадка в течение 24 ч.
Рис. 2. Схема поляризационных кривых процесса электроэкстракции и марганца.
На аноде происходит выделение кислорода и окисление марганца:
Стандартный потенциал образования МnO9 φ°Mn 2+ /MnO2 равен
+ 1,28 в. Следовательно, даже в кислой среде выделение кислорода должно идти преимущественно перед окислением Мn 2+ . При наличии условий, создающих значительное перенапряжение при выделении кислорода, расход марганца на образование МnО2 может стать значительным и достигнуть 20—25% от количества марганца, осажденного на катоде. Полученная на аноде двуокись марганца, нерастворимая в серной кислоте, образует шлам, частично удерживающийся на аноде, частично падающий на дно ванны. Образование МnO2 наряду с основной реакцией выделения кислорода сильно зависит от материала анода.
При использовании чисто свинцового анода доля этой реакции в анодном пространстве весьма значительна. При применении оловянно-свинцового, сурьмяно-свинцового и свинцово-серебряного электродов, на которых перенапряжение выделения кислорода меньше, количество анодно осажденного марганца снижается. Обе реакции, протекающие на аноде, приводят к повышению кислотности электролита. Поскольку оно недопустимо для катодного процесса, электролиз марганца ведут с разделением анодного и катодного пространства диафрагмой.
В питающем растворе содержание марганца составляет 30 —40 г/л. Содержание его в католите поддерживается в пределах 10—12 г/л. Концентрация марганца в анолите несколько ниже, чем в католите за счет анодного окисления и выпадения металла в шлам.
Очень велика роль сульфата аммония. Он выполняет две функции: является буферным агентом, поддерживающим постоянство рН раствора и предотвращающим выделение гидроокиси марганца, и увеличивает электропроводность раствора. Повышению катодного выхода по току способствует добавка в электролит небольших количеств иона SO 2- 3 (для этого через раствор перед электролизом пропускают сернистый газ SO 2). Сульфит-ион восстанавливается у катода с образованием коллоидной серы, адсорбирующейся на участках катода, активных к выделению водорода. Это затрудняет его выделение. Наличие SO2 в растворе приводит к некоторому загрязнению катодного осадка серой.
Влияние катодной плотности тока на процесс электролиза в диапазоне плотностей от 200 до 600 а/м 2 незначительно. При мень ших плотностях возрастает доля выделяющегося водорода и снижается выходило току. Увеличение плотности тока сверх 550-600 а/м 2 приводит к получению неровной поверхности осадка.
Величина анодной плотности тока оказывает существенное влияние на интенсивность процесса анодного окисления марганца. Установлено, что повышение анодной плотности тока по отношению к катодной способствует понижению скорости этого нежелательного процесса. Поэтому анодную плотность тока поддерживают примерно в 2 раза более высокой, чем катодную. Достигается это перфорированием анодов.
Температуру электролита поддерживают в пределах 30—40° С. Повышение температуры увеличивает электропроводность раствора, однако повышение ее свыше 40° С приводит к образованию дендритов на катоде и снижению выхода по току за счет уменьшения перенапряжения выделения водорода.
Ванны для электролиза марганца изготовляют из дерева и футеруют рольным свинцом или винипластом. Анодные пространства отделяют от катодных диафрагмами. Диафрагмы натягиваются на рамах, внутри которых подвешивают электроды (или аноды, или катоды). Аноды изготовляют из различных сплавов на свинцовой основе; катоды — из нержавеющей стали.| Для облегчения сдирки катодного осадка стальные катоды перед погружением в ванну полируют и обрабатывают слабым раствором силиката натрия. В качестве диафрагм используют водопроницаемый холст (бельтинг), полихлорвиниловую ткань. Электролиз длится 24 ч Анодная плотность тока составляет 870—970 а/м 2 , катодная 350— 500 а/м 2 , напряжение на ванне 4,2—5,3 в. При выходе по току 50—70% удельный расход электроэнергии составляет 10000 квт • ч/т.
Статья на тему Получение марганца
http://prosto-o-slognom.ru/chimia/517_marganets_Mn.html
http://znaesh-kak.com/x/e/%D0%BF%D0%BE%D0%BB%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D0%B5-%D0%BC%D0%B0%D1%80%D0%B3%D0%B0%D0%BD%D1%86%D0%B0