Свойства углеводородов. Получение углеводородов
Теория к заданию 13 из ЕГЭ по химии
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов, ароматических углеводородов
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
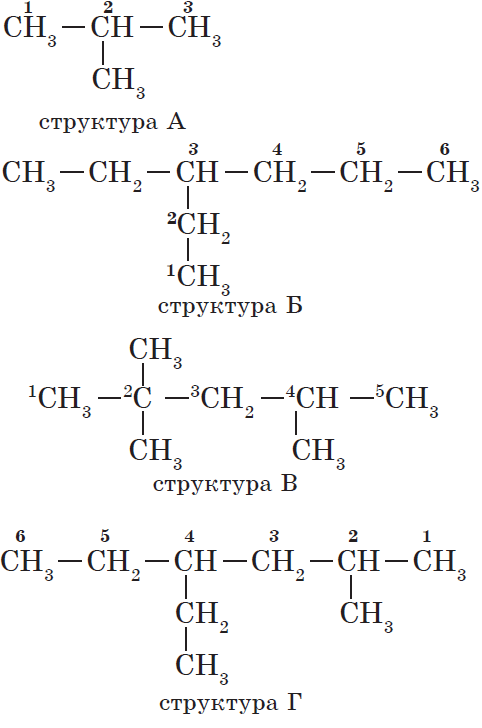
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_<12>$ до $С_<15>Н_<32>$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
Термическое расщепление углеводородов:
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
При нагревании до температуры $1500°С$ возможно образование ацетилена:
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
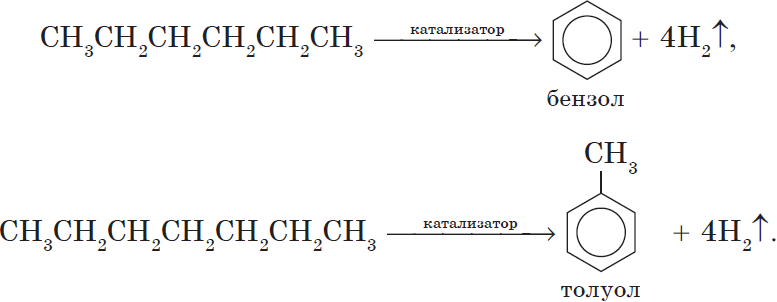
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_<10>$ — пентен, $С_6Н_<12>$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_<10>$ – $С_<16>Н_<32>$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
3. Гидрогалогенирование (присоединение галогеноводорода).
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
— алкадиены с сопряженными двойными связями;
— алкадиены с изолированными двойными связями
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
Цис-, транс-изомерия (пространственная и геометрическая)
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Физические и химические свойства алкадиенов
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_<10>$ — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_<10>$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
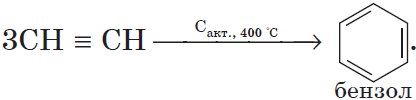
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
Это вещество используется для получения хлоропрена:
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(. -H_2C-CCl=CH-CH_2-. )_n$
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Реакции, характеризующие основные способы получения кислородсодержащих соединений
1. Гидролиз галогеналканов. Вы уже знаете, что образование галокеналканов при взаимодействии спиртов с галогеноводородами — обратимая реакция. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой:
Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле. Например:
2. Гидратация алкенов — присоединение воды по $π$-связи молекулы алкена — уже знакома вам, например:
Гидратация пропена приводит, в соответствии с правилом Марковникова, к образованию вторичного спирта — пропанола-2:
3. Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов:
4. Окисление алкенов. Гликоли, как уже отмечалось, могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена):
5. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода (II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка):
Необходимую для этой реакции смесь угарного газа и водорода, называемую также синтез-газом ($СО + nН_2О$), получают при пропускании паров воды над раскаленным углем:
6. Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времен:
Способы получения альдегидов и кетонов
Альдегиды и кетоны могут быть получены окислением или дегидрированием спиртов. Еще раз отметим, что при окислении или дегидрировании первичных спиртов могут быть получены альдегиды, а вторичных спиртов — кетоны:
Реакция Кучерова. Из ацетилена в результате реакции гидратации получается уксусный альдегид, из гомологов ацетилена — кетоны:
При нагревании кальциевых или бариевых солей карбоновых кислот образуются кетон и карбонат металла:
Способы получения карбоновых кислот
Карбоновые кислоты могут быть получены окислением первичных спиртов альдегидов:
Ароматические карбоновые кислоты образуются при окислении гомологов бензола:
Гидролиз различных производных карбоновых кислот также приводит к получению кислот. Так, при гидролизе сложного эфира образуются спирт и карбоновая кислота. Как уже говорилось выше, реакции этерификации и гидролиза, катализируемые кислотой, обратимы:
Гидролиз сложного эфира под действием водного раствора щелочи протекает необратимо, в этом случае из сложного эфира образуется не кислота, а ее соль:
Основные способы получения углеводородов
Содержание:
Крекинг алканов с бoльшей длиной цепи
Процесс, который используется в промышленности и протекает:
- в присутствии катализатора при t 450-500 o C
- в отсутствие катализатора при t 500-700 o C
можно выразить общей формулой:
I. Получение алканов
Парафины линейного строения. CnH2n+2
- Гидрирование. Гидрирование каменного угля проводят при повышенном нагревании и давления, в качестве катализатора следует брать никель. Конечным продуктом является метан.
Гидрирование непредельных углеводородов.
Ацетиленовых и алкадиенов:
Крекинг с длинной цепью. Такой способ повсеместно используется в лабораторном получении алканов и алкенов. Крекинг проходит в присутствии катализатора при нагревании около 500 o C или при около 600 o C и больше без него.
Декарбоксилирование солей карбоновых кислот. Метод Дюма. Проводят сплав твёрдых карбоновых кислот с твёрдыми щёлочами.
Реакция Вюрца. Данная способ используется для удлинения углеродной цепи, протекает при воздействии мет-го натрия на галогеналкан при нормальных условиях.
Реакция Фишера-Тропша. Этот способ используется для получения парафинов линейного строения. Синтез-газ (CO+H2) под воздействие высокого нагревания пропускают через катализатор.
Гидролиз карбида алюминия. Получение метана.Способ получения CH4 путём реакции между Al4C3 (карбид алюминия (III)) c H2O.
II. Получение алкенов. CnH2n
Парафины пропускают над никелем, палладием, или платиной при нагревании от 400 до 600 о С. В результате от наименее насыщенных водородом углеродных атомов в цепи отрываются два водорода. Реакцию можно продолжить и получить алкин.
Данная реакция происходит при воздействии спиртового рас-ра щёлочи на галогеналкан и при дальнейшем нагревании смеси.
Данная реакция проходит при катализаторе от 450 до 500 o C или от 500 до 700 o C без.
Дегалогенирование вицинальных дигалогеналканов.
Винициальными называют те галогеналканы, в которых атомы галогена присоединены к рядом стоящим атомам углерода.
Суть метода во взаимодействии на дигалогеналкан цинком или магнием.
Реакция происходит при нагревании спирта около 140-160 O С в присутствии H2SO4.
III. Получение алкинов. CnH2n-2
Две молекулы метанаCH4 нагревают до 1500 О С в результате происходит его дегидрирование и удвоение углеродной цепи.
Реакция происходит при взаимодействии дигалогеналкана со спиртовым раствором щёлочи.
Гидролиз карбида кальция.
Реакция воздействия водой или бескислородных кислот на карбиды щелoчных и щелочноземельных металлов.
Реакция происходит при нагревании от 400 до 600 0 С в присутствии катализатора (никеля или палладия).
Реакция происходит при действии на дигалогеналкан спиртовым раствором щёлочи.
IV. Получение алкадиенов. CnH2n-2
Пoлучение бутадиена -1,3 из этанола.
Реакция происходит при действии на дигалогеналкан спиртовым раствором щёлочи.
Дегидрирование бутана и бутена-1.
Получение дивинила. Для получения дивинила (бутадиен-1,3) в промышленном производстве проводят реакции по методу каталитического дегидрирования бутана и бутена-1. Реакция происходит при температуре от 500 до 600 о С в присутствии катализатора Cr2O3.
Изопрен — мономер для производства синтетического каучука. В присутствии катализаторов (оксида хрома (III) и оксида алюминия (III)) изопентан под высоким давлением нагревают до 150-160 0 С.
V. Получение ароматических углеводородов. CnH2n-6
Реакцию проводят с катализатором в виде активированного угля при нагревании до 400 О С.
Реакция происходит при тех же условиях, что и тримеризация ацетилена, но в результате получается не бензол, а мезиэтилен (1,3,5-триметилбензол).
Реакция образования гомологов бензола при его взаимодействии с галогеналканами, алкенами и спиртами при нагревании с разными катализаторами.
Декарбоксилирование солей ароматических карбоновых кислот.
Способ заключается в сплавлении соли ароматической кислоты с твёрдой щёлочью. В результате образуется арен с меньшим количеством углеродных атомов.
Реакция получения аренов из углеводородов линейного строения с условием наличия в цепи от шести углеродных атомов. Реакцию проводят при сильном нагревании в присутствии катализатора (платина, палладий, никель).
Реакция образования ароматического соединения с таким же количеством атомов углерода в цепи из циклического углеводорода. Реакцию проводят при повышенной температуре при воздействии катализатора (никель, палладий).
41. Органическая химия  Читать 0 мин.
Читать 0 мин.
41.573. Способы получения углеводородов
Основные способы получения алканов:
Алканы выделяют из природных источников
(природный и попутный газы, нефть, каменный уголь).
1. Крекинг нефти (промышленный способ)
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
2. Гидpиpование непредельных углеводоpодов:
C n H 2n + H 2 = C n H 2n+2
C n H 2n-2 + 2H 2 = C n H 2n+2
3. Из синтез-газа (СО + Н 2 ) получают смесь алканов:
CO + 3H 2 = CH 4 + H 2 O
4. Синтез более сложных алканов из галогенопроизводных с меньшим числом атомов углерода – реакция Вюрца
$CH_3$ $-CL + 2Na + Cl-$ $CH_3 = CH_3-CH_3+2NaCl$
$CH_3$ $COONa + NaOH$ $ = CH_4 + Na_2CO_3$
6. реакция Кольбе (электролиз солей карбоновых кислот)
$2CH_3COOK + 2H_2O \stackrel<\text<эл.ток>> <\longrightarrow>H_2 + 2KOH + C_2H_6 + 2CO_2$
7. Разложение карбида алюминия
Al 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4
Основные способы получения алкенов:
1. Дегидрирование алканов:
C n H 2n+2 = C n H 2n +H 2
2. Гидрирование алкинов:
C n H 2n-2 + H 2 = C n H 2n
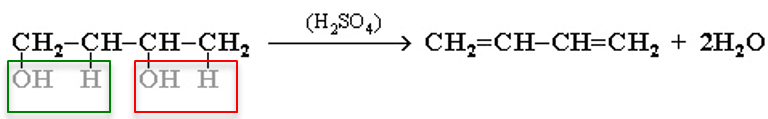
3. Дегидратация спиртов:
R-CH 2 -CH 2 -OH = R-CH=CH 2 + H 2 O (катализатор: серная кислота и нагревание выше 180 градусов)
«Отрыв атома водорода происходит от наименее гидрогенизированного атома углерода»
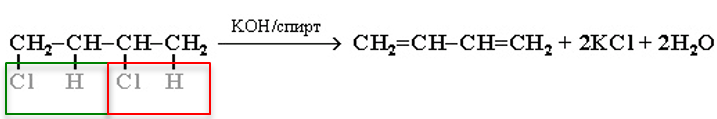
4. Дегидрогенирование моногалогеналканов (по правилу Зайцева):
R-CH 2 -CH 2 -Г +NaOH ( спиртовой раствор) →R-CH=CH 2 +NaГ+H 2 O
5. Дегалогенирование дигалогеналканов:
Основные способы получения алкинов:
1. Термический крекинг метана:
2. Гидролиз карбида кальция:
3. Вследствие большой энергоемкости этот метод экономически менее выгоден. Для синтеза гомологов ацетилена применяют следующие методы.
Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке):
$R-CH_2-CBr_2-R + 2KOH \stackrel<\text<спирт>> <\longrightarrow>R-C \equiv C-R + 2KBr+2H_2O \\ R-CHBr-CHBr-R + 2KOH \stackrel<\text<спирт>> <\longrightarrow>R-C \equiv C-R + 2KBr +2H_2O$
4. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:
$CH_3-C\equiv CNa + Br-C_2H_5\longrightarrow CH_3-C\equiv C-C_2H_5 + NaBr$
Основные способы получения алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинила из бутана, содержащегося в газах нефтепереработки и в попутных газах:
2. Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен: $\chemfig
3. Синтез дивинила по Лебедеву:
4. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
5. Действие спиртового раствора щелочи на дигалогеналканы:
Основные способы получения циклоалканов:
1. Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений. При переработке нефти выделяют главным образом циклоалканы (С5 — С 7 )
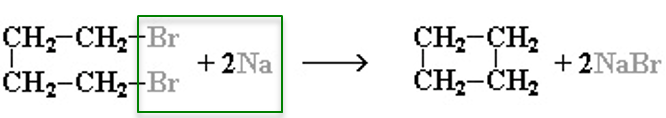
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца) приводит к образованию различных циклоалканов:
(вместо металлического натрия используется также порошкообразный цинк).
Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения.
3. циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
http://bingoschool.ru/manual/osnovnyie-sposobyi-polucheniya-uglevodorodov/
http://reshutest.ru/theory/11?theory_id=382
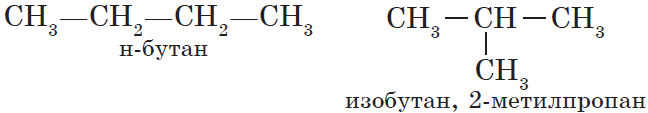

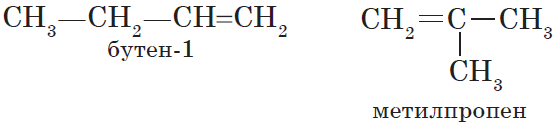
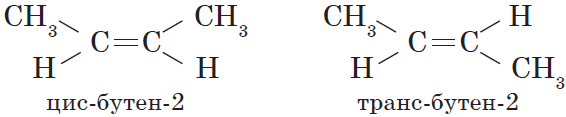
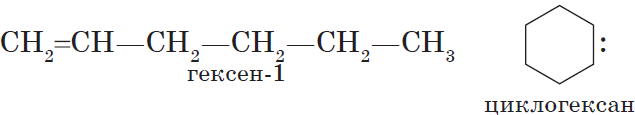
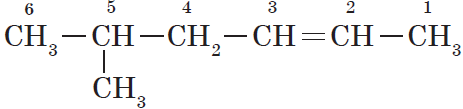
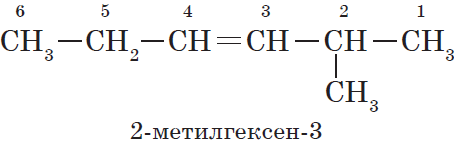
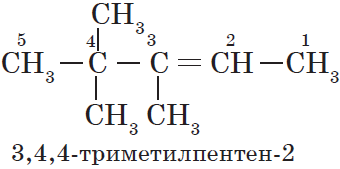
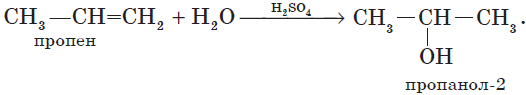
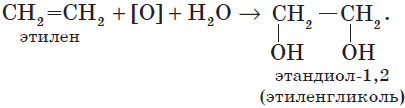
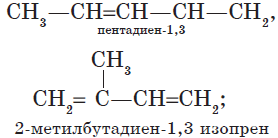

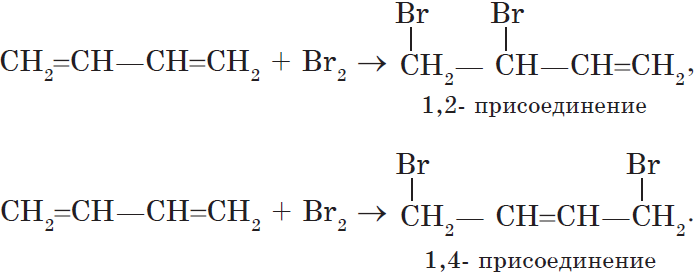
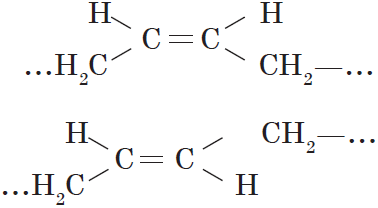
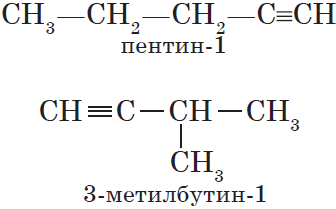
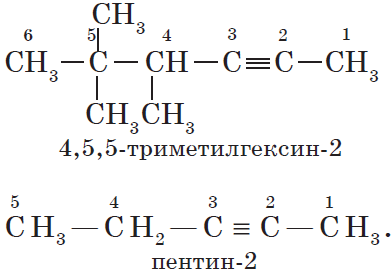
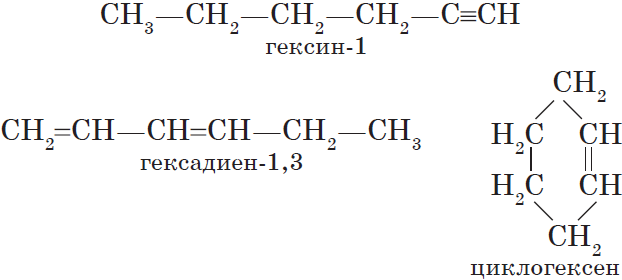
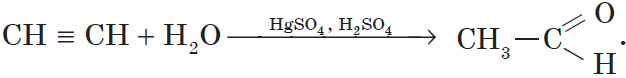
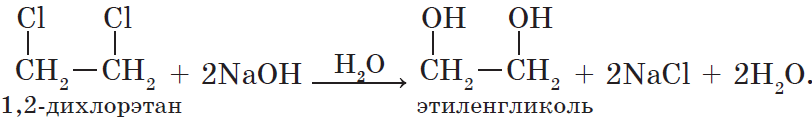
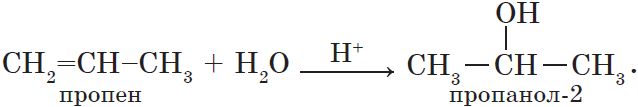
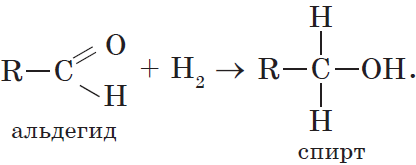
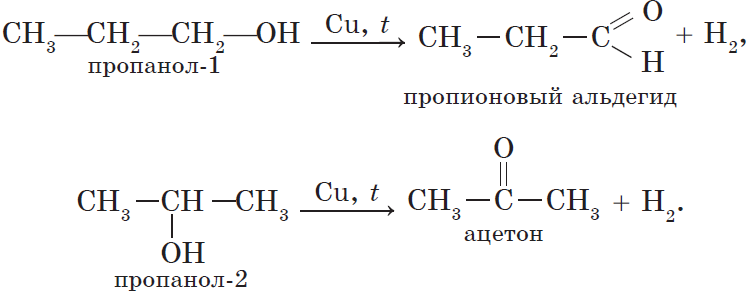
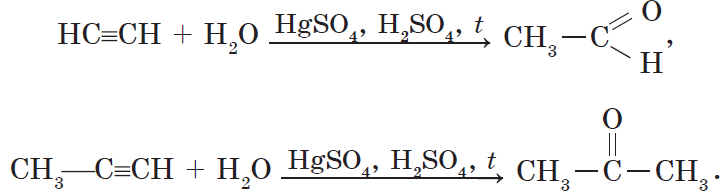
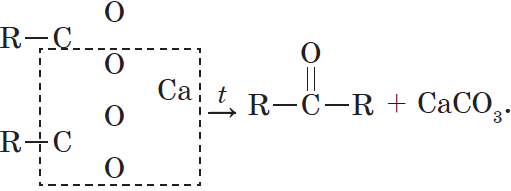
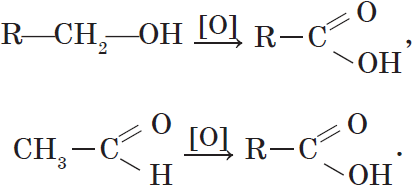
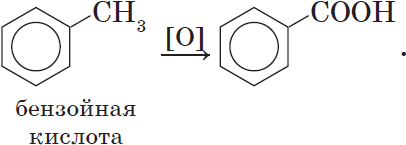
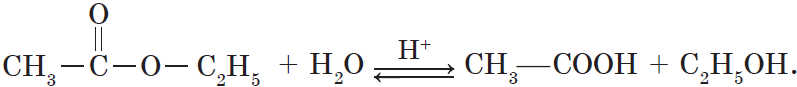
























 Читать 0 мин.
Читать 0 мин.