Тестовые задания. 2.2.1 Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы
2.2.1 Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы, называются…
2.2.2 Величины, которые не зависят от массы термодинамической системы, называются…
2.2.3 Значение стандартных энергий Гиббса можно определить по уравнению 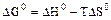
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия.
2.2.4 Значение стандартных энергий Гиббса можно определить по уравнению 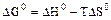
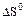
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия.
2.2.5 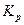
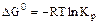
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия;
г) универсальная газовая постоянная.
2.2.6 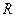
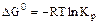
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия;
г) универсальная газовая постоянная.
2.2.7 Порядок и знак величины 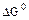
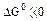
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 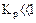
в) существует равновесие.
2.2.8 Порядок и знак величины 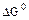
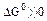
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 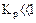
в) существует равновесие.
2.2.9 Порядок и знак величины 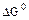
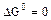
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 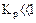
в) существует равновесие;
2.2.10 Значение 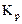
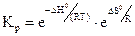
Укажите условия протекания экзотермической реакции:
а) 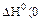
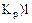
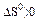
б) 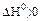
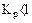
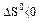
в) 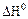
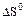
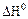
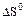
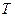
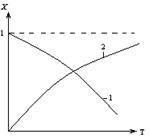
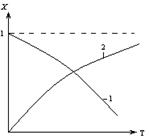
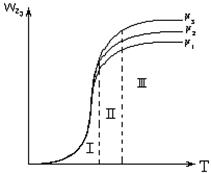
2.2.11 На рисунке представлена зависимость равновесной степени превращения от температуры.
Кривая 1 – это для…
а) экзотермических реакций;
б) эндотермических реакций.
2.2.12 На рисунке представлена зависимость равновесной степени превращения от температуры.
Кривая 2 – это для…
а) экзотермических реакций;
б) эндотермических реакций.
2.2.13 Для определения термодинамической константы равновесия пользуются приближенным уравнением 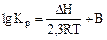
Для экзотермической реакции при повышении температуры 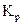
в) остается неизменной.
2.2.14 Для определения термодинамической константы равновесия пользуются приближенным уравнением 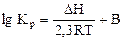
Для эндотермической реакции при повышении температуры 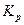
в) остается неизменной.
2.2.15 Для экзотермической реакции с повышением температуры равновесная степень превращения …
в) остается неизменной.
2.2.16 Для эндотермической реакции с повышением температуры равновесная степень превращения…
в) остается неизменной.
2.2.17 Для смещения равновесия слева направо для реакции 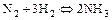
в) изменение давления не влияет на равновесие реакции.
2.2.18 Для смещения равновесия слева направо для реакции
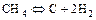
в) изменение давления не влияет на равновесие реакции.
2.2.19 Для смещения равновесия слева направо для реакции
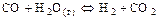
в) изменение давления не влияет на равновесие реакции.
2.2.20 При увеличении концентрации исходных реагентов равновесие смещается в сторону…
а) исходных реагентов;
б) целевых продуктов;
в) увеличение концентрации реагентов не влияет на равновесие.
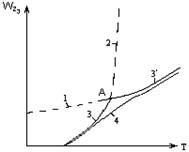 |
Рисунок 2.1 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.21 На рисунке 2.1 кривая 1 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.22 На рисунке 2.1 кривая 2 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.23 На рисунке 2.1 кривая 3 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.24 На рисунке 2.1 кривая 4 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
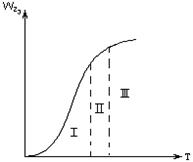 |
Рисунок 2.2 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.25 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.26 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.27 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
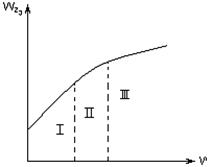 |
в) диффузионная область.
Рисунок 2.3 – Зависимость общей скорости гетерогенного
процесса от линейной скорости газового потока
2.2.28 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.29 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.30 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
 |
в) диффузионная область.
Рисунок 2.4 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.31 На рисунке 2.4 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.32 На рисунке 2.4 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.33 На рисунке 2.4 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.34 Скорость гетерогенного процесса можно определить по уравнению 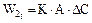
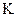
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.35 Скорость гетерогенного процесса можно определить по уравнению 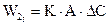
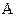
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.36 Скорость гетерогенного процесса можно определить по уравнению 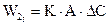
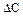
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.37 Для гетерогенного процесса 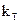
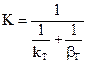
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.38 Для гетерогенного процесса 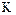
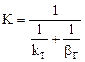
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.39 Для гетерогенного процесса 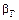
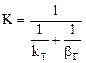
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.40 Для гетерогенного процесса 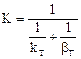
Если 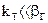
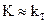
а) в кинетической области;
б) в переходной области;
в) в диффузионной области.
2.2.41 Для гетерогенного процесса 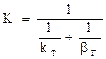
Если 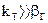
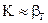
Следовательно, процесс протекает…
а) в кинетической области;
б) в переходной области;
в) в диффузионной области.
2.2.42 Для повышения скорости гетерогенного процесса, протекающего в диффузионной области ( 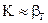
а) увеличивать скорость газового потока, усиливать его турбулизацию;
б) повышать температуру;
в) повышать температуру и применять катализатор.
2.2.43 Для повышения скорости гетерогенного процесса, протекающего в кинетической области ( 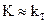
а) увеличивать скорость газового потока, усиливать его турбулизацию;
б) повышать температуру;
в) повышать температуру и применять катализатор.
2.2.44 Для реакции 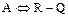
а) целевого продукта;
б) исходного реагента;
в) не изменяется.
2.2.45 Для реакции 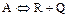
а) целевого продукта;
б) исходного реагента;
в) не изменяется.
Ответы к тестовым заданиям
| Номер вопроса | |||||||||||||||
| 2.2 | а | б | а | б | в | г | а | б | в | а | а | б | б | а | б |
| Номер вопроса | |||||||||||||||
| 2.2 | а | а | б | в | б | а | б | в | г | а | б | в | в | б | а |
| Номер вопроса | |||||||||||||||
| 2.2 | а | б | в | а | б | в | в | а | б | а | в | а | в | а | б |
Дата добавления: 2015-06-22 ; просмотров: 1026 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Гетерогенные реакции — формулы, особенности протекания и примеры задач
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
Термическое разложение солей на газообразные и твердые продукты — типичный пример гетерогенной реакции:
СаСО3 -> СаО + СО2,
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Zn + H2SO4 -> ZnSO4 + Н2.
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
Са3(РО4)2 ↓ ↔ 3Са 2+ + 2PO4 3- .
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
ПР = [Са 2+ ] 3 [PO4 3- ] 2 / [Са3(РО4)2 ].
Величина [Са3(РО4)2] = const, и ПР(Са3(РО4)2) = [Са 2+ ] 3 [PO4 3- ] 2 .
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.
Среди приведенных уравнений реакций укажите реакции соединения?
Химия | 5 — 9 классы
Среди приведенных уравнений реакций укажите реакции соединения.
1) 2НgO = 2Hg + O2 2)Fe + S = FeS 3)CaCO3 = CaO + CO2 4)2H2 + O2 = 2H2O 5) CH4 + 2O2 + 2H2O.
Реакции соединения : 2, 4.
Реакции соединения, когда вещества соединяются
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения :CaO ⇒ Ca(OH)₂ ⇒ CaCO₃ ⇒ CO₂?
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения :
CaO ⇒ Ca(OH)₂ ⇒ CaCO₃ ⇒ CO₂.
ПОМОГИТЕ?
Назвать соединения : ZnO, SO2, CaO.
Записать уравнения реакций получения данных соединений.
Помогите плиз?
Укажите номер уравнения реакции замещения : А) 2H₂ + O → 2H₂O В) 2H₂O → 2H₂ + O₂ Б) 2Na + 2H₂O → 2NaOH + H₂ Г)Fe + CuCl₂ → Cu + FeCl₂
Среди приведенных уравнение реакций укажите реакции соединения :
А) 2HgO→ 2Hg + O₂ Б) CaCO₃ → CaO + CO₂ Д) CH₄ + 2O₂ → CO₂ + 2H₂
В) Fe + S → FeS Г) 2H₂ + O₂ → 2H₂O₂.
Составьте уравнения соответствующих реакцийCaO⇒Ca(OH)₂⇒CaCO₃⇒Ca(HCO₃)₂⇒CaCO₃⇒CaO?
Составьте уравнения соответствующих реакций
Укажите какие из приведенных реакций являются окислительно — восстановительными определите типы реакцияCao + CO2 — — > CO2 — — > CaCo3пожалуйста решите))?
Укажите какие из приведенных реакций являются окислительно — восстановительными определите типы реакция
Cao + CO2 — — > CO2 — — > CaCo3
Напишите уравнение реакций отражающий следующую :Ca(OH)₂⇒CaCO₃⇒Ca(HCO₃)₂⇒CaCO₃⇒CaCl₂?
Напишите уравнение реакций отражающий следующую :
Допишите уровние реакции и укажите тип реакций ;а)PtO2 = ?
Допишите уровние реакции и укажите тип реакций ;
Осуществите приведенные ниже превращения, напишите уравнения соответствующих реакций?
Осуществите приведенные ниже превращения, напишите уравнения соответствующих реакций.
Ca → CaO → CaCO3 → CaO → CaCl2.
1)укажите уравнение реакции соединения2)укажите уравнение реакции разложения3)укажите уравнение реакции замещения4)укажите уравнение реакцию обменя?
1)укажите уравнение реакции соединения
2)укажите уравнение реакции разложения
3)укажите уравнение реакции замещения
4)укажите уравнение реакцию обменя.
Закончите уравнения приведенных ниже реакций, укажите тип каждой реакции?
Закончите уравнения приведенных ниже реакций, укажите тип каждой реакции.
Вопрос Среди приведенных уравнений реакций укажите реакции соединения?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 5 — 9 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Массу. Агрегатное состояние характерно для вещества.
ПРАВИЛЬНЫЙ ОТВЕТ ПЕРВЫЙ АГРЕГАТНОЕ СОСТОЯНИЕ.
Молярна маса FeSO4 = 152 г / моль Складемо наступну пропорцію із якої порахуємо масу заліза у 0. 1 г сульфату заліза Отже бачимо, що така маса сульфату заліза вдвічі перевищує його добову потребу.
Металлические, Ионные, Молекулярные, Атомные.
Металлические, Молекулярные, Атомные, Ионные.
http://sprint-olympic.ru/uroki/himija/99020-geterogennye-reakcii-formyly-osobennosti-protekaniia-i-primery-zadach.html
http://himia.my-dict.ru/q/7906356_sredi-privedennyh-uravnenij-reakcij-ukazite-reakcii/