Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Сульфат аммония
| Сульфат аммония | |
|---|---|
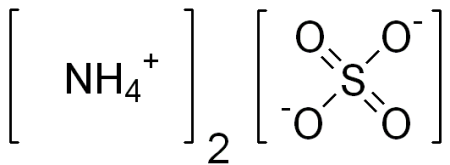 | |
| Систематическое наименование | аммония сульфат |
| Традиционные названия | аммоний сернокислый |
| Хим. формула | (NH4)2SO4 |
| Рац. формула | H8N2O4S |
| Состояние | твёрдое |
| Молярная масса | 132,14052 г/моль |
| Плотность | 1,769 г/см³ (20 °C) |
| Т. плав. | 235-280 °C |
| Т. разл. | 218 °C |
| Мол. теплоёмк. | 187,4 Дж/(моль·К) |
| Энтальпия образования | −1180,26 кДж/моль |
| Растворимость в воде | 75,4 г/100 г (20 °C) |
| ГОСТ | ГОСТ 9097-82 ГОСТ 3967-78 ГОСТ 10873-73 ГОСТ Р 51520-99 |
| Рег. номер CAS | 7783-20-2 |
| PubChem | 24538 |
| Рег. номер EINECS | 231-984-1 |
| SMILES | |
| Кодекс Алиментариус | E517 |
| ChEBI | 62946 |
| ChemSpider | 22944 |
| ЛД50 | 2840 (крысы; орально) |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфат аммония (аммоний сернокислый, лат. ammonium sulphate ), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Очистка
- 5 Применение
- 6 Воздействие на человека
Физические свойства
Чистый сульфат аммония — бесцветные прозрачные кристаллы, в измельчённом виде — белый порошок. Запаха не имеет. Гигроскопичность невысокая.
Образует кристаллы ромбической сингонии, пространственная группа Pnma, параметры ячейки a = 0,7782 нм , b = 0,5993 нм , c = 1,0636 нм , Z = 4 .
Плотность (при 20 °C) — 1,766 г/см 3 .
Растворимость в воде (г/100 мл):
Растворимость в других растворителях (г/100 г):
- муравьиная кислота 95 %: 25,4 (16,5 °C);
- ацетон: нерастворим;
- этанол: нерастворим;
- диэтиловый эфир: нерастворим.
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, соль Мора.
Химические свойства
При нагревании до 147 °С сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
При повышении температуры выше 500 °С гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
Сульфат аммония окисляется до молекулярного азота сильными окислителями, например перманганатом калия.
Получение
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.
Очистка
Технический сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную соль Мора.
Согласно Карякину, для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа (II) в железо (III). Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата (III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение
Сульфат аммония широко применяется как азотное-серное минеральное удобрение (в РФ — по ГОСТ-9097-82) в легкоусвояемой форме, не содержащей NO 3- -групп и не едкое, его можно применять в любое время года. Содержит 21 % азота и 24 % серы. Подкисляет почву.
Также используется в производстве вискозного волокна как компонент осадительной ванны.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того, находит применение при получении марганца электролизом, в производстве аммониево-алюминиевых квасцов, корунда. Добавляется к стекольной шихте для улучшения её плавкости.
Воздействие на человека
Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки E517. В пищевой индустрии добавка сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.
Составить уравнение реакции образования сульфата аммония исходя из : a) аммиака и серной кислоты б) гидроксида аммония и серной кислоты?
Химия | 10 — 11 классы
Составить уравнение реакции образования сульфата аммония исходя из : a) аммиака и серной кислоты б) гидроксида аммония и серной кислоты.
Вычислить по уравнению реакций а) и б), сколько каждого из реагентов необходимо для получения 200г сульфата аммония.
А) 2NH3 + H2SO4 = (NH4)2SO4
По условию дано масса сульфата аммония(NH4)2SO4 равна 200г.
Молярная масса сульфата аммония(NH4)2SO4 равна 2 * (14 + 4 * 1) + 32 + 4 * 16 = 132 г / моль.
Количество вещества(NH4)2SO4 равна 200 / 132 = 1, 5моль
Количество вещества аммиака равно 2 * 1, 5 = 3 моль
Молярная масса аммиакаNH3 равна 14 + 3 * 1 = 17г / моль
Масса аммиакаNH3 равна 17 * 3 = 51 г
Объем аммиакаNH3 равен 22, 4 * 3 = 67, 2л
Количество вещества серной кислотыH2SO4равно 1, 5 моль
Молярная масса серной кислотыH2SO4равна 2 * 1 + 32 + 4 * 16 = 98г / моль
МассаH2SO4равна 98 * 1, 5 = 147 г
б) 2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O
По условию дано масса сульфата аммония(NH4)2SO4 равна 200г.
Молярная масса сульфата аммония(NH4)2SO4 равна 2 * (14 + 4 * 1) + 32 + 4 * 16 = 132 г / моль.
Количество вещества(NH4)2SO4 равна 200 / 132 = 1, 5моль
Количество вещества аммонияNH4OH равно 1, 5 * 2 = 3моль
Молярная масса аммонияNH4OH равна 14 + 4 * 1 + 16 + 1 = 35г / моль
Масса аммонияNH4OH равна 3 * 35 = 105г
Количество вещества серной кислотыH2SO4равно 1, 5 моль
Молярная масса серной кислотыH2SO4равна 2 * 1 + 32 + 4 * 16 = 98г / моль
МассаH2SO4равна 98 * 1, 5 = 147 г.
Через 350 г раствора серной кислоты с массовой долей 7% пропустили аммиак до образования сульфата аммония ?
Через 350 г раствора серной кислоты с массовой долей 7% пропустили аммиак до образования сульфата аммония .
Вычислите объем вступившего в реакцию газа.
Вычислите сколько киллограмов 78% серной кислоты прореогирует со 134, 4 л аммиака (н?
Вычислите сколько киллограмов 78% серной кислоты прореогирует со 134, 4 л аммиака (н.
У. )при получение сульфата аммония.
Масса сульфата аммония получится при реакции серной кислоты и аммиака с массой 3, 4 г?
Масса сульфата аммония получится при реакции серной кислоты и аммиака с массой 3, 4 г.
1. Сколько килограммов 78 — процентного раствора серной кислоты необходимо для получения сульфата аммония из 102 кг аммиака?
1. Сколько килограммов 78 — процентного раствора серной кислоты необходимо для получения сульфата аммония из 102 кг аммиака?
На завтра надо, пожалуйста помогите!
В четырех колбах без этикеток находятся растворы : сульфата натрия, сульфата аммония, серной кислоты и нитрата натрия?
В четырех колбах без этикеток находятся растворы : сульфата натрия, сульфата аммония, серной кислоты и нитрата натрия.
Как идентифицировать эти вещества?
Составьте уравнения реакций.
Написать молекулярные и молекулярно — ионные уравнения реакций а) Нитрат бария и сульфат аммония, б) гидроксид алюминия и соляная кислота, в) карбонат калия и серная кислота?
Написать молекулярные и молекулярно — ионные уравнения реакций а) Нитрат бария и сульфат аммония, б) гидроксид алюминия и соляная кислота, в) карбонат калия и серная кислота.
Какое количество аммиака и серной кислоты необходимо для образования сульфата аммония массой 26, 4г ?
Какое количество аммиака и серной кислоты необходимо для образования сульфата аммония массой 26, 4г ?
Уравнение реакции в молекулярном и ионном виде : карбонат аммония + соляная кислота ; сульфат аммония + гидроксид натрия ; сульфид аммония + сульфат магния ; ортофосфат аммония + хлорид бария ?
Уравнение реакции в молекулярном и ионном виде : карбонат аммония + соляная кислота ; сульфат аммония + гидроксид натрия ; сульфид аммония + сульфат магния ; ортофосфат аммония + хлорид бария ;
Даны растворы сульфата аммония, серной кислоты и нитрата аммония?
Даны растворы сульфата аммония, серной кислоты и нитрата аммония.
Определите опытным путем, в какой пробирке находится каждое из перечисленных веществ.
Напишите уравнение реакций.
Помогите пожалуйста произвести превращение?
Помогите пожалуйста произвести превращение!
Гидроксид аммония — хлорид аммония — сульфат аммония — гидросульфат аммония — серная кислота.
Вы находитесь на странице вопроса Составить уравнение реакции образования сульфата аммония исходя из : a) аммиака и серной кислоты б) гидроксида аммония и серной кислоты? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 10 — 11 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
Восстановители — металлы Окислители — галогены.
Восстановители — металлы, водород, уголь, оксид углерода(2), сероводород H2S, аммиак NH3, соляная кислота HCL Окислители — Галогены, перманганат калия KMnO4.
1)Mg + S = MgS(сульфид магния), реакция присоединения 2)Mg + 2HCl + MgCl2 + H2(ХЛОРИД МАГНИЯ), РЕАКЦИЯ ЗАМЕЩЕНИЯ 3)2Mg + O2 = 2MgO(ОКСИД МАГНИЯ), РЕАКЦИЯ ПРИСОЕДИНЕНИЯ 4)BaO + H2O = Ba(OH)2(ГИДРОКСИД БАРИЯ), РЕАКЦИЯ ПРИСОЕДИНЕНИЯ 5)S + O2 = SO2(СЕРНИ..
MgS MgHCl MgO2 BaO2 + H2O SO2 SO3 + H2O BaBr + H2O.
Да. Правильно. Мой брат с этого писал и пятерка. Так что смело списывай))).
Это специальные помощники для домашних заданий. Поэтому ответ правильный.
500×20 = 10000 и вийдет число яке треба.
3NaOH(изб. ) + FeCl3 — — > Fe(OH)3 осадок + 3NaCl 1) m(в — ва) FeCl3 = 200 * 0. 05 = 10 г 2) n(FeCl3) = m / Mr = 10 / 162. 5 = 0. 062 моль 3) по уравнениюn(FeCl3) = n(Fe(OH)3) = 0. 062 моль 4) m(Fe(OH)3) = n * Mr = 0. 062 * 107 = 6. 58г Ответ ..
KF — ионная связь LiCl — ионная связь CaCl2 — ионная связь Связь между металлом и неметаллом, электроотрицательность которых сильно различается.
http://chem.ru/sulfat-ammonija.html
http://himia.my-dict.ru/q/9235_sostavit-uravnenie-reakcii-obrazovania-sulfata-ammonia/














