Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Сульфат аммония
| Сульфат аммония | |
|---|---|
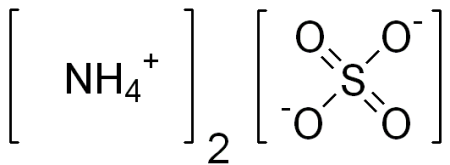 | |
| Систематическое наименование | аммония сульфат |
| Традиционные названия | аммоний сернокислый |
| Хим. формула | (NH4)2SO4 |
| Рац. формула | H8N2O4S |
| Состояние | твёрдое |
| Молярная масса | 132,14052 г/моль |
| Плотность | 1,769 г/см³ (20 °C) |
| Т. плав. | 235-280 °C |
| Т. разл. | 218 °C |
| Мол. теплоёмк. | 187,4 Дж/(моль·К) |
| Энтальпия образования | −1180,26 кДж/моль |
| Растворимость в воде | 75,4 г/100 г (20 °C) |
| ГОСТ | ГОСТ 9097-82 ГОСТ 3967-78 ГОСТ 10873-73 ГОСТ Р 51520-99 |
| Рег. номер CAS | 7783-20-2 |
| PubChem | 24538 |
| Рег. номер EINECS | 231-984-1 |
| SMILES | |
| Кодекс Алиментариус | E517 |
| ChEBI | 62946 |
| ChemSpider | 22944 |
| ЛД50 | 2840 (крысы; орально) |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфат аммония (аммоний сернокислый, лат. ammonium sulphate ), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Очистка
- 5 Применение
- 6 Воздействие на человека
Физические свойства
Чистый сульфат аммония — бесцветные прозрачные кристаллы, в измельчённом виде — белый порошок. Запаха не имеет. Гигроскопичность невысокая.
Образует кристаллы ромбической сингонии, пространственная группа Pnma, параметры ячейки a = 0,7782 нм , b = 0,5993 нм , c = 1,0636 нм , Z = 4 .
Плотность (при 20 °C) — 1,766 г/см 3 .
Растворимость в воде (г/100 мл):
Растворимость в других растворителях (г/100 г):
- муравьиная кислота 95 %: 25,4 (16,5 °C);
- ацетон: нерастворим;
- этанол: нерастворим;
- диэтиловый эфир: нерастворим.
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, соль Мора.
Химические свойства
При нагревании до 147 °С сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
При повышении температуры выше 500 °С гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
Сульфат аммония окисляется до молекулярного азота сильными окислителями, например перманганатом калия.
Получение
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.
Очистка
Технический сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную соль Мора.
Согласно Карякину, для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа (II) в железо (III). Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата (III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение
Сульфат аммония широко применяется как азотное-серное минеральное удобрение (в РФ — по ГОСТ-9097-82) в легкоусвояемой форме, не содержащей NO 3- -групп и не едкое, его можно применять в любое время года. Содержит 21 % азота и 24 % серы. Подкисляет почву.
Также используется в производстве вискозного волокна как компонент осадительной ванны.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того, находит применение при получении марганца электролизом, в производстве аммониево-алюминиевых квасцов, корунда. Добавляется к стекольной шихте для улучшения её плавкости.
Воздействие на человека
Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки E517. В пищевой индустрии добавка сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.
Сульфат аммония серная кислота уравнение
Сульфат аммония (NH4)2SO4 — аммонийная соль серной кислоты, аммоний сернокислый.
Сульфат аммония содержит 21 % азота и 24 % серы. Это химически нейтральная кристаллическая соль белого цвета, хорошо растворимая в воде.
Гигроскопичность её слабая, поэтому при длительном хранении не слёживается и сохраняет сыпучесть.
Свойства сульфата аммония
Показатель
Технические характеристики сульфата аммония
Наименование показателя
Способы получения сульфата аммония
В лаборатории сульфат аммония получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами проводят в приборе для получения растворимых веществ в твёрдом виде. Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие:
— процесс нейтрализации серной кислоты синтетическим аммиаком;
— использование аммиака из газа коксовых печей для его химической реакции с серной кислотой;
— получение в результате обработки гипса растворами карбоната аммония;
— получение при переработке отходов, остающихся после производства капролактама (в результате перегруппировки Бекмана при производстве капролактама).
Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.
Области применения сульфата аммония
Сульфат аммония – одно из широкоприменяемых в сельском хозяйстве минеральных удобрений. Используется под все сельскохозяйственных культур (от картофеля до цитрусовых) на черноземах и сероземах. Удобрение обладает ценным качеством – низкой миграционной способностью, так как катион аммония активно поглощается почвой и это предохраняет его от вымывания. Поэтому сульфат аммония рекомендуют вносить на легких почвах, при орошении, т.е. там, где есть потенциальная опасность потери азота удобрения за счет миграционных явлений. Аммонийный азот сульфата аммония усваивается растениями. Сера необходима для питания всех культур, так как входит в состав некоторых синтезируемых растениями незаменимых аминокислот.
Сульфат аммония применяют в производстве вискозного волокна.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Используется в технологии хлорирования воды с аммонизацией , вводится в обрабатываемую воду за несколько секунд до хлора, с хлором образует хлораммины — связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики вредной для организма человека, сокращается расход хлора, уменьшается корозия труб водовод.
В средствах тушения пожаров сульфат аммония применяется в качестве антипирена, в горной промышленности — как гелеобразующий компонент при профилактической обработке выработанного пространства, в состав взрывчатого вещества сульфат аммония вводится для снижения горючести и устранения опасности самопроизвольного воспламенения
Также сульфат аммония применяется для производства:
• гербицидов;
• кормов для животных;
• выделки кож;
• строительной изоляции.
Развитие рынка сульфата аммония обуславливается в большей степени не спросом со стороны потребляющих отраслей и рыночными факторами, а наличием данного вида продукции, предложением сульфата аммония на рынке. Т.е. развитие производства капролактами и коксохимической продукции обуславливает и развитие производства сульфата аммония . Недостаточность спроса на внутреннем рынке будет провоцировать возрастание экспортных поставок сульфата аммония.







