Эксперимент «Клеточка Траубе»
Как вырастить искусственную клетку в ходе химической реакции
Биология и химия тесно связаны между собой. В этом познавательном опыте мы научимся с помощью химической реакции создавать искусственные клетки!
Реагенты и оборудование:
- 5%-ный раствор медного купороса;
- таблетки желтой кровяной соли;
- дистиллированная вода;
- химический стакан;
- кювета;
- пинцет.
Пошаговая инструкция
Растворим медный купорос (50 г) в дистиллированной воде (950 мл). Перельем раствор в кювету. Добавим несколько таблеток желтой кровяной соли.
Пояснение процессов
Полупроницаемость — способность избирательно пропускать вещества через мембрану. Подобным свойством обладают мембраны клеток растений. При взаимодействии желтой кровяной соли с сульфатом меди образуется полупроницаемый гексацианоферрат(II) меди. Этот эффект открыл немецкий химик и физиолог Мориц Траубе. Его работа показала, что можно найти такие химические соединения, которые подобно растительной клеточке будут вбирать из окружающей среды одни вещества и выделять другие:
2CuSO₄ + K₄[Fe(CN)₆] → Cu₂[Fe(CN)₆] + 2K₂SO₄
Концентрация желтой кровяной соли внутри клетки больше, чем концентрация сульфата меди снаружи. В результате вода проникает в клетку, тем самым увеличивая ее до тех пор, пока концентрации желтой кровяной соли и сульфата меди не уравняются. За счет давления мембрана из гексацианоферрата(II) меди постоянно разрывается. На месте разрыва опять взаимодействуют сульфат меди и желтая кровяная соль, и пленка образуется снова. Поэтому клеточка Траубе растет неравномерно.
Меры предосторожности
Проводите эксперимент в защитных перчатках и очках.
Внимание! Не пытайтесь повторить этот опыт самостоятельно.
Сульфат меди и желтая кровяная соль уравнение
Русский физикохимик Михаил Васильевич Ломоносов в 1750 г. занялся разработкой способа получения синей краски, известной в то время как «берлинская лазурь». Химическая формула этого соединения, уточненная уже в наши дни, — KFe[Fe(CN)6], гексацианоферрат(III) железа(II)-калия. Попутно Ломоносов изучал взаимодействие желтой и красной кровяных солей, гексацианоферрата(II) и гексацианоферрата(III) с различными солями других металлов.
Изумительные «растения», похожие на нитевидные «водоросли» или ветки «подводного кустарника», вырастают в сосудах при взаимодействии в водном растворе гексацианоферратов калия с хлоридом или сульфатом меди (II), марганца(II), цинка (II), никеля(II), кобальта(II), хрома(III). Для этого в раствор 30-50 г желтой кровяной соли — гексацианоферрата(II) калия K4[Fe(CN)6] в 1 л воды добавляют два-три кристаллика этих солей.
Появление водных «растений» связано с реакциями, в которых выпадают в осадок малорастворимые комплексные соли типа K2Zn[Fe(CN)6] или KCr[Fe(CN)6]. Эти соединения покрывают внесенные кристаллики полупроницаемой пленкой. Через пленку просачивается вода из раствора. Давление под пленкой возрастает, в некоторых местах она прорывается, и там начинают расти длинные изогнутые «трубочки» — «ветки» Диковинных растений. Рост будет продолжаться до тех пор, пока не израсходуется весь кристалл внесенной соли.
 |
 |
 Бурый «кустарник» вырастает, когда в раствор 100-150 г сульфата меди (II) CuSO4 в 1 л воды добавить кристаллики красной кровяной соли — гексацианоферрата(III) калия K3[Fe(CN)6]. Его появление вызвано реакцией образования малорастворимого гексацианоферрата(III) меди(II)-калия KCu[Fe(CN)6]: Зеленые тонкие «водоросли» с синеватым оттенком появляются, если в водный раствор хлорида никеля(II) NiCl2 (30-50 г в 1 л воды) опустить кристаллик гексацианоферрата(III) калия K3[Fe(CN)6]. Они образуются по реакции: |
 Химический осенний сад с желтой «травой» и золотистыми «листьями» вырастает, если в водный раствор, содержащий 30 — 50 г хромата калия К2СгО4 в 1 л воды, добавить кристаллик дигидрата хлорида бария ВаСl2·2Н2O. В желтом растворе будет протекать осаждение хромата бария ВаСrО4: Тонкие нити желтого цвета, похожие на траву, появятся и в водном растворе нитрата свинца(II) Pb(NO3)2, содержащем 100 — 150 г соли в 1 л воды, если в него опустить несколько кристалликов хромата калия. В этом случае «трава» это малорастворимый хромат свинца РbСгO4: |
| Возьмите жидкое стекло — полисиликаты натрия и калия с условной формулой Na2SiO3, разбавьте его 2-3-х кратным количеством воды и налейте в банку. Далее добавляем в раствор кристаллики различных солей: сульфатов (или хлоридов, нитратов) меди Cu, двухвалентного железа Fe(II), трехвалентного железа Fe(III), хрома Cr(III), кобальта Co, никеля Ni, марганца Mn, магния Mg, цинка Zn, свинца Pb. Количество каждой соли — «на кончике шпателя». Соли можно брать как вместе, так и по отдельности. Когда кристаллики опустятся на дно, начнется рост «водорослей». Используя соли разных металлов, можно вырастить «водоросли» разнообразных цветов. Например, соли Cu(II) дают «водоросли» светло-синего цвета, Co — фиолетового, Ni — светло-зеленого, Zn, Mg и Pb — белого, Fe(III) — бурого. «Марганцевые водоросли» первоначально окрашены в белый цвет, но затем становятся бурыми (в результате окисления Mn(II)). Другой вариант опыта. В высокую стеклянную банку налейте 1 л жидкого стекла, добавьте 0,5-0,7 л воды и перемешайте. После этого нужно одновременно из двух стаканов вылить в эту банку водные растворы сульфата хрома(III) Cr2(SO4)3 и хлорида железа(III) FeCl3. В результате вырастут силикатные «водоросли» желто-зеленого цвета, которые, причудливо переплетаясь, опускаются сверху вниз. Рост «водорослей» — следствие образования силикатов железа, меди и хрома, образующихся в результате обменных реакций, уравнения которых условно можно условно записать следующим образом: Добавив в ту же банку по каплям раствор сульфата меди(II) CuSO4, мы заселим аквариум причудливыми «морскими звездами» и круглыми колючими «морскими ежами» синего цвета: Рецепты «химических водорослей» (Химия и жизнь) Раствор Концентрация раствора, % Кристаллы K4[Fe(CN)6] 3-5 CdCl2, ZnCl2, MnCl2, FeCl2, CoCl2, NiCl2, FeCl3 K3[Fe(CN)6] 3-5 3-5 K3[Fe(CN)6] 10-15 K3[Fe(CN)6] 3-5 K4[Fe(CN)6] Желтая кровяная соль
| ||||||
| Систематическое наименование | Гексацианоферрат(II) калия | |||||
|---|---|---|---|---|---|---|
| Хим. формула | K4[Fe(CN)6] | |||||
| Рац. формула | C6N6FeK4 | |||||
| Состояние | безводный — бесцветные кристаллы, тригидрат — бледно-жёлтые кристаллы | |||||
| Молярная масса | 368,35 г/моль | |||||
| Плотность | тригидрата 1,85 г/см³ | |||||
| Т. плав. | 69-71 °C | |||||
| Т. разл. | ||||||
| ГОСТ | ГОСТ 4207-75 ГОСТ 6816-79 | |||||
| Рег. номер CAS | 13943-58-3 | |||||
| PubChem | 9605257 | |||||
| Рег. номер EINECS | 237-722-2 | |||||
| SMILES | ||||||
| Кодекс Алиментариус | E536 | |||||
| ChEBI | 30059 | |||||
| ChemSpider | 7879375 и 20162028 | |||||
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | ||||||
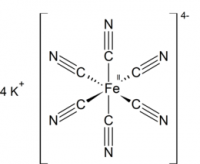
Гексацианоферрат (II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферроат калия, жёлтая кровяная соль) — комплексное соединение двухвалентного железа K4[Fe(CN)6], существующее обычно в виде тригидрата K4[Fe(CN)6]·3H2O.
Содержание
- 1 История открытия и тривиальные названия
- 2 Получение
- 3 Химические свойства
- 4 Токсичность
- 5 Применение
- 6 Мнемоническое правило
История открытия и тривиальные названия
- жёлтая кровяная соль — кристаллогидрат K4[Fe(CN)6]·3H2O.
- жёлтое синькали
- жёлтая соль
- кровещелочная соль
Тривиальное название появилось из-за того, что ранее «жёлтую кровяную соль» получали путём сплавления отходов с боен (в частности, крови) с поташом и железными опилками. Это, а также жёлтый цвет кристаллов, обусловили название соединения.
Получение
В настоящее время в промышленности получают из отработанной массы после очистки газов на газовых заводах (содержит цианистые соединения); эту массу обрабатывают суспензией Ca(OH)2; фильтрат, содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он также может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит Fe 2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
2. затем осадок растворяется в избытке KCN с образованием «жёлтой кровяной соли»:
Fe2[Fe(CN)6] + 12CN − → 3[Fe(CN)6] 4−
Химические свойства
Светло-жёлтые кристаллы с тетрагональной решеткой, существующие в виде тригидрата K4[Fe(CN)6]·3H2O.
Плотность 1,853 г/см³ при 17 °C. Растворимость в воде 31,5 г/100 г при 25 °C, 48,3 г при 50 °C. Практически не растворяется в эфире, этаноле, пиридине, анилине, этилацетате.
Гексацианоферрат(II) калия диамагнитен.
Выше 87,3 °C (по другим данным, выше 120 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
В реакции с соляной кислотой выделяется белый осадок железистосинеродистой кислоты (H4[Fe(CN)6]).
С концентрированной серной кислотой реагирует по уравнению:
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
С солями металлов в степени окисления +2 и +3, образует малорастворимые соединения гексацианоферратов(II) (см. в разделе «применение»).
В водных растворах окисляется хлором и другими окислителями, такими, как пероксид водорода до K3[Fe(CN)6]:
Анион [Fe(CN)6] 4− очень прочен (константа нестойкости 8⋅10 -36 ), не разлагается ни щелочами, ни кислотами, устойчив по отношению к воздуху; поэтому растворы ферроцианидов не показывают реакций ни на Fe 2+ , ни на CN − .
Токсичность
Нейтральное вещество, не разлагается в воде и внутри человеческого организма. Летален при приёме перорально дозы в 6400 мг/кг (испытания на крысах).
Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
В Российской Федерации широко применяют при производстве продуктов питания — соли, творожных продуктов, в виноделии и пр.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
1. Fe 3+ : образуется малорастворимый синий осадок «берлинской лазури»:
или, в ионной форме
Получающийся гексацианоферрат(II) калия-железа(III) слабо растворим (с образованием коллоидного раствора), поэтому носит название «растворимая берлинская лазурь».
2. Zn 2+ : образуется белый осадок гексацианоферрата(II) цинка-калия:
или, в ионной форме
3. Cu 2+ : из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
или, в ионной форме
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли.
Мнемоническое правило
Для того, чтобы запомнить формулу желтой кровяной соли K4[Fe(CN)6] и не спутать её с красной кровяной солью K3[Fe(CN)6], существует мнемоническое правило:
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — желтая кровяная соль (калий железистосинеродистый) K4[Fe(CN)6]. «Red» — 3 буквы, то есть 3 атома калия — красная кровяная соль (калий железосинеродистый) — K3[Fe(CN)6].
[Fe(CN)6] 4–
аммония • бария • железа(II) • железа(III) • калия • кальция • кобальта • магния • марганца • меди(II) • натрия • никеля • олова • свинца • стронция • таллия • цинка • Железистосинеродистая кислота H4[Fe(CN)6]
[Fe(CN)6] 3–
железа(II) • железа(II,III) • калия • кальция • кобальта • меди(I) • натрия • неодима(III) • олова • свинца • Железосинеродистая кислота H3[Fe(CN)6]
http://chemistry-chemists.com/Video/colloidal-garden-5.html
http://chem.ru/zheltaja-krovjanaja-sol.html