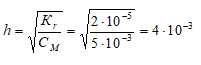Напишите уравнения реакций в молекулярной ионной и сокращённой ионной формах между следующими веществами, находящиеся в водном растворе : сульфатом меди (2) и сульфидом калия?
Химия | 5 — 9 классы
Напишите уравнения реакций в молекулярной ионной и сокращённой ионной формах между следующими веществами, находящиеся в водном растворе : сульфатом меди (2) и сульфидом калия.
CuSO₄ + K₂S = CuS + K₂SO₄
Cu²⁺ + SO₄²⁻ + 2K⁺ + S²⁻ = CuS + 2K⁺ + SO₄²⁻
Составьте уравнения реакций, протекающих в водных растворах, в молекулярной, ионной и сокращенной ионной формах : между сульфатом железа (3) и гидроксидом натрия?
Составьте уравнения реакций, протекающих в водных растворах, в молекулярной, ионной и сокращенной ионной формах : между сульфатом железа (3) и гидроксидом натрия.
Запишите сокращённое ионное уравнение качественной реакции на сульфат — ион и составьте три соответствующих молекулярных уравнения?
Запишите сокращённое ионное уравнение качественной реакции на сульфат — ион и составьте три соответствующих молекулярных уравнения.
Напишите уравнения в следующих реакциях, протекающих в водных растворах, в молекулярной, ионной, в сокращённой ионной форме 1?
Напишите уравнения в следующих реакциях, протекающих в водных растворах, в молекулярной, ионной, в сокращённой ионной форме 1.
Напишите ураавнения реакций в молекулярной и ионой форме между растворами сульфата меди и гидроксида натрия?
Напишите ураавнения реакций в молекулярной и ионой форме между растворами сульфата меди и гидроксида натрия.
Помогите?
Напишите уравнения реакций в молекулярном и ионном виде между : А) сульфидом меди (2) и сульфидом натрия ; Б) гидроксидом натрия и карбонатом калия.
Напишите уравнения реакций в молекулярной , ионной и сокращенной ионной формах между следущими веществами , находящимися в растворе а) хлорид цинка и гидроксидом лития б)сульфидом калия и соляной кисл?
Напишите уравнения реакций в молекулярной , ионной и сокращенной ионной формах между следущими веществами , находящимися в растворе а) хлорид цинка и гидроксидом лития б)сульфидом калия и соляной кислотой.
Напишите уравнение реакций в молекулярной , ионной и сокращенной ионной формах между следущими веществами ?
Напишите уравнение реакций в молекулярной , ионной и сокращенной ионной формах между следущими веществами .
Находящимися в водном растворе : а) сульфатом калия и нитратом бария.
Напишите (в молекулярной и сокращенной ионной форме) уравнение гидролиза иодида марганца (2)?
Напишите (в молекулярной и сокращенной ионной форме) уравнение гидролиза иодида марганца (2).
Укажите реакцию среды Напишите ( в молекулярной и сокращённой ионной форме) уравнение обменной реакции в водном растворе, с помощью которой можно получить карбонат цинка.
Написать ионно — молекулярное и молекулярное уравнение гидролиза сульфида калия?
Написать ионно — молекулярное и молекулярное уравнение гидролиза сульфида калия.
Как влияет на равновесие гидролиза прибавление к раствору следующих веществ :
а) бромоводородной кислоты ;
б) гидроксида лития ;
Напишите в молекулярной и ионно — молекулярной форме уравнения реакции следующих веществ : K2s + NiSO4?
Напишите в молекулярной и ионно — молекулярной форме уравнения реакции следующих веществ : K2s + NiSO4.
Если вам необходимо получить ответ на вопрос Напишите уравнения реакций в молекулярной ионной и сокращённой ионной формах между следующими веществами, находящиеся в водном растворе : сульфатом меди (2) и сульфидом калия?, относящийся к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
Na2O2 + 2Na = 2Na2O Na2O + H2O = 2NaOH FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl 2NaCl + BaSO4 = Na2SO4 + BaCl2 BACL2 + 2H2O = BA(OH)2 + 2HCL Fe(NO3)2 + Ba(OH)2 = Fe(OH)2 + Ba(NO3)2 Fe(OH)2 = FeO + H2O FeO + H2SO4(разб. ) = FeSO4 + H2O FeSO4 + H2 = H2SO4 + F..
А)по закону разбавлении w1m1 = w2m2 240·8 = x·274 x = 7% б) 1)Находим массу соли в исходном растворе 240·0, 08 = 19, 2г 2) масса соли в новым растворе , после добавлении карбоната калии 34 + 19, 2 = 53, 2 3) Общая масса нового раствора 240 + 34 = 274..
Mr(K3PO4) = 3 * 39 + 31 + 4 * 16 = 212 W(K) = 117 / 212 = 0. 55 = 55%.
С основными оксидами.
BaO не реагирует с основными оксидами и с основаниями.
2Na + CL2 = 2NaCL H2 + CL2 = 2HCL 2NaBr + CL2 = 2NaCL + Br2 2KI + CL2 = 2KCL + I2 2) 2Na + 2H2O = 2NaOH + H2 2NaOH + FeCL2 = Fe(OH)2 + 2NaCL Fe(OH)2 = FeO + H2O FeO + 2HCL = FeCL2 + H2O.
1) СН3 — СН(ОН) — СН(СН3) — С(СН3)(С2Н5) — СН2 — СН3 2) СН3 — СН(ОН) — СН(С2Н5) — СН(СН3) — СН2 — СН2 — СН3 3) СН3 — СН2 — С(СН3)(СН3) — СОН 4) СН3 — СН2 — СН(С2Н5) — СН2 — СН(С2Н5) — СОН 5) СН3 — СН(СН3) — СН(СН3) — С(СН3)(С2Н5) — СН2 — СООН 6) СН3 ..
В 1 моль ортофосфата натрия содержится 69 г натрия, то 23 г его будет содержаться в 1 / 3 моль данного вещества.
Наверное так) удачи ).
Пожалуйста здесь электронный бананс можно ещё электонно — ионный написать.
Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ);
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,298
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,232
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://buzani.ru/zadachi/obshchaya-khimiya/1413-gidrokarbonat-natriya-zadachi-15-16
http://www.soloby.ru/797616/%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%B3%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7%D0%B0-%D1%81%D0%BB%D0%B5%D0%B4%D1%83%D1%8E%D1%89%D0%B8%D1%85-%D1%81%D1%83%D0%BB%D1%8C%D1%84%D0%B8%D0%B4%D0%B0-%D1%81%D1%83%D0%BB%D1%8C%D1%84%D0%B0%D1%82%D0%B0