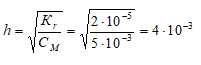Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
Составьте ионные и молекулярные уравнения гидролиза солей, приведенных в вашем задании. Хлорид алюминия, сульфид калия.
| 🎓 Заказ №: 22236 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Составьте ионные и молекулярные уравнения гидролиза солей, приведенных в вашем задании. Укажите реакцию среды в растворе соли. Рассчитайте константу гидролиза. Если соль гидролизуется ступенчато, константу рассчитайте только для первой ступени. Хлорид алюминия, сульфид калия.
Решение: Гидролизом называется обменная реакция вещества с водой. При этом происходит смещение равновесия диссоциации воды H2O H OH вследствие связывания одного из ионов (или обоих) с образованием мало-диссоциирующего или труднорастворимого вещества. Гидролизу подверга-ются соли, образованные либо слабой кислотой, либо слабым основанием, либо и тем и другим.
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Гидролиз хлорида алюминия
AlCl3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
AlCl3 + HOH ⇄ AlOHCl2 + HCl
Полное ионное уравнение
Al 3+ + 3Cl — + HOH ⇄ AlOH 2+ + 2Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Al 3+ + HOH ⇄ AlOH 2+ + H +
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
AlOHCl2 + HOH ⇄ Al(OH)2Cl + HCl
Полное ионное уравнение
AlOH 2+ + 2Cl — + HOH ⇄ Al(OH)2 + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
AlOH 2+ + HOH ⇄ Al(OH)2 + + H +
Третья стадия (ступень) гидролиза
Молекулярное уравнение
Al(OH)2Cl + HOH ⇄ Al(OH)3 + HCl
Полное ионное уравнение
Al(OH)2 + + Cl — + HOH ⇄ Al(OH)3 + H + + Cl —
Сокращенное (краткое) ионное уравнение
Al(OH)2 + + HOH ⇄ Al(OH)3 + H +
Среда и pH раствора хлорида алюминия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
http://lfirmal.com/%D0%A1%D0%BE%D1%81%D1%82%D0%B0%D0%B2%D1%8C%D1%82%D0%B5-%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B5-%D0%B8-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B5-%D1%83%D1%80%D0%B0%D0%B2-6/
http://chemer.ru/services/hydrolysis/salts/AlCl3