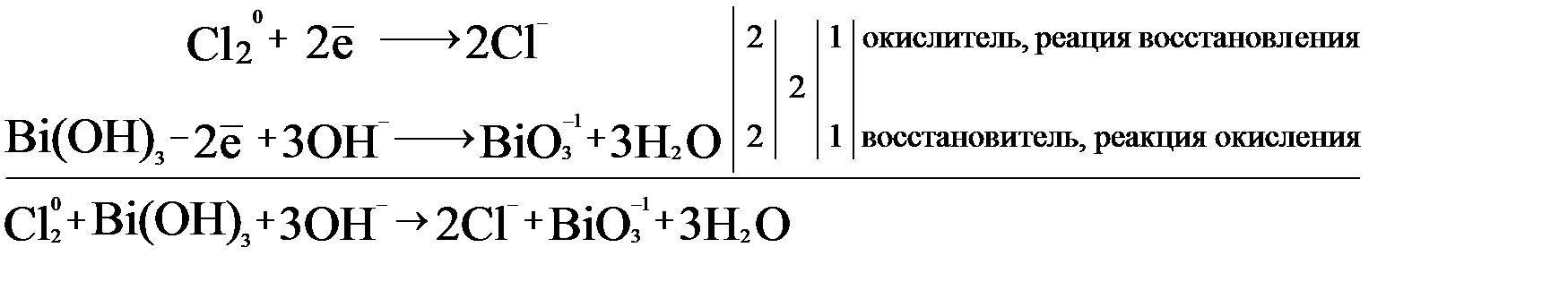Составить уравнения: Сульфид мышьяка + азотная кислота = мышьяковая кислота + сернистый газ + диоксид азота + вода. Определите окислитель и восстановитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,282
- разное 16,837
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Примеры сложных окислительно-восстановительных реакций
а) ОВР с тремя атомами, которые меняют степень окисления
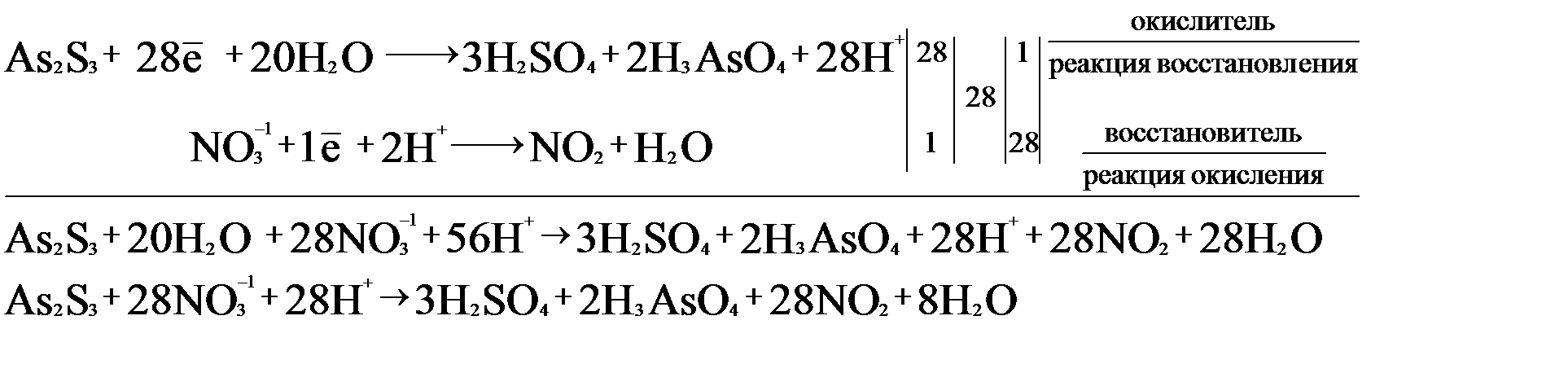
Разнообразие окислительно-восстановительных процессов не ограничивается только приведенными выше примерами. В некоторых реакциях степень окисления меняют сразу три и даже более атомов. Рассмотрим такой случай ОВР на примере взаимодействия сульфида мышьяка (III) и концентрированной азотной кислоты.
Расставим степени окисления:
+3 -2 +1 +5 –2 +1 +5 -2 +1 +6 -2 +4 -2 +1 -2
После определения степеней окисления выявляем, что окислителем является азот в составе азотной кислоты, а восстановители – это мышьяк и сера в составе сульфида мышьяка. Следует отметить, что сульфид мышьяка – это бинарное соединение, в котором атом As +3 проявляет амфотерные свойства (атом мышьяка в степени окисления +5 обладает кислотными свойствами). Поэтому сера, как и в любом сульфиде, проявляет степень окисления –2.
Составление реакции окисления начинаем с записи сульфида мышьяка в виде молекулы, потому что это твердое вещество и неэлектролит. Продукты полуреакции также запишем в виде молекул (азотная кислота – концентрированная). В сульфиде мышьяка три атома серы и два атома мышьяка, поэтому перед серной кислотой ставим коэффициент 3, а перед ортомышьяковой кислотой – коэффициент 2. Схема полуреакции:
Количество электронов, которое отдают оба восстановителя, записывается суммарно одним числом. Одна сера отдает восемь электронов, а мышьяк – два. Общее количество электронов = 3 ∙ 8е + 2 ∙ 2е = 28е.
В этой схеме левая часть не содержит атомов водорода и кислорода, поэтому недостающие атомы берем из молекул воды, поскольку она является продуктом реакции:
Полуреакция восстановления имеет следующий вид:
На основании двух полуреакций составим электронно-ионный баланс:
Исходя из полученного баланса, расставляем коэффициенты в уравнение:
б) ОВР с неизвестным продуктами реакции
Зачастую, при выполнении домашних и контрольных заданий по теме ОВР у студентов возникают трудности по составлению неизвестной правой части уравнения реакции. Рассмотрим на примере:
Пример 18.Уравнять ОВР методом электронного баланса. Определить продукты реакции: Bi(OH)3 + Cl2 + NaOH = NaBiO3 + …
Определяем степени окисления в исходных веществах и продуктах реакции.
+3 -2 +1 0 +1 -2 +1 +1 +5 -2
Определив степени окисления известных участников реакции, можно сделать вывод, что висмут +3, является восстановителем, а хлор, следовательно, окислителем (см. п. 3.1).
Окислитель является простым веществом, полуреакция восстановления в данном случае:
Реакция окисления составляется с использованием молекулы гидроксида висмута, который переходит в висмутат-ион:
Bi(OH)3 – 2e → BiO3 — , в щелочной среде восстановитель берет кислород из гидроксогрупп с образованием воды по следующей схеме:
На основании двух полуреакций составим электронно-ионный баланс:
После составления баланса, можно дописать продукты реакции:
Полученный в ходе реакции восстановления хлорид-ион не может существовать самостоятельно. Поэтому он присоединяет находящиеся в избытке катионы натрия. Расставляем коэффициенты в уравнение реакции.
Подсчет количества атомов в левой и правой частях уравнения дает следующие результаты: Bi: 1=1; Cl: 2=2; Na: 3=3; H: 6=6; O: 6=6.
Равенство количества атомов говорит о том, что уравнение дописано полностью, а коэффициенты расставлены правильно.
Контрольные вопросы и задания
1. Определите степени окисления атомов в окислительно-восстановительных реакциях (ОВР), составьте электронные балансы, и уравняйте реакции:
2. Какие типы окислительно-восстановительных реакций существуют? Определите степени окисления атомов, с помощью электронного баланса уравняйте в ОВР и укажите тип реакции:
3. Какую роль в ОВР выполняют восстановители? Назовите наиболее важные восстановители.
4. Какую роль в ОВР выполняют окислители? Назовите наиболее важные окислители.
5. Что такое окислительно-восстановительная двойственность? Рассмотрите на примере сернистой кислоты:
6. Из приведенных ниже веществ выберите типичные окислители. Докажите их свойства с помощью уравнения реакции.
7. Из приведенных ниже веществ выберите типичные восстановители. Докажите их свойства с помощью уравнения реакции.
8. Из приведенных ниже веществ выберите соединение способное проявлять окислительно-восстановительную двойственность. Докажите его свойства с помощью уравнения реакции.
Заключение
Современная химия представляет собой разветвленную область знаний о составе и строении веществ. Познания в области физико-химических свойств простых и сложных веществ помогают в дальнейшем специалистам при разработке и внедрении технологий, сводящих к минимуму вред окружающей среде. Многие сегодняшние экологические проблемы обусловлены производством различных химических веществ и отсутствием современных методов очистки отходящих газов и промышленных вод.
Изучение свойств представителей классов неорганических соединений позволяет в дальнейшем избежать ошибок при обращении с ними. Так, известно, что нельзя воду добавлять к концентрированной серной кислоте, так как реакция протекает с выделением большого количества теплоты и возможно разбрызгивание кислоты и, как следствие, ожоги кожных покровов и что еще хуже — глаз.
Чтобы химические соединения адекватно прочитывались, химиками различных стран ведется поиск номенклатурных правил, максимально отражающих состав и свойства соединений. Химическая номенклатура складывается из формул и названий. Переход от химических формул к названиям и (наоборот) определяется системой номенклатурных правил.
Номенклатурные правила ИЮПАК по составлению названий в различных странах адаптированы к традициям национального языка, так чтобы каждое название возможно легче произносилось и записывалось. В английском варианте правил ИЮПАК названия веществ строятся «по ходу формул», например , H2S — водорода сульфид , NaCl- натрия хлорид. Однако для русского языка больше подходит французский вариант номенклатуры с «обратным» чтением формул. В названиях на первом месте, как мы видели, должно стоять название электроотрицательной составляющей в именительном падеже, а на втором – обозначение электроположительной составляющей в родительном падеже.
Для ограниченного числа распространенных кислот и их солей правила ИЮПАК рекомендуют использование традиционных названий, например, H2SO4— серная кислота, Na2SO4 — сульфат натрия. В учебном пособии более широко использованы традиционные названия основных классов неорганических соединений, что связано с необходимостью адаптации студентов I курса нехимических специальностей к вузовской программе по химии.
Дата добавления: 2019-04-03 ; просмотров: 10058 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Химические свойства мышьяка
Мышьяк является неметаллом, образует соединения, подобные по его химическим свойствам. Однако, наряду с неметаллическими свойствами, мышьяк проявляет и металлические. На воздухе при обычных условиях мышьяк слегка окисляется с поверхности. Ни в воде, ни в органических растворителях мышьяк и его аналоги нерастворимы.
Мышьяк химически активен. На воздухе при нормальной температуре даже компактный (плавленый) металлический мышьяк легко окисляется, при нагревании порошкообразный мышьяк воспламеняется и горит голубым пламенем с образованием оксида As2O3. Известен также термически менее устойчивый нелетучий оксид As2O5.
При нагревании (в отсутствие воздуха) As возгоняется (температура возгонки 615 о С). Пар состоит из молекул As4 с ничтожной (порядка 0,03%) примесью молекул As2.
Мышьяк относится к группе элементов окислителей-восстановителей. При действии сильных восстановителей он проявляет окислительные свойства. Так, при действии металлов и водорода в момент выделения он способен давать соответствующие металлические и водородистые соединения:
При действии сильных окислителей мышьяк переходит в трех- или пятивалентное состояние. Например, при накаливании на воздухе мышьяк, окисляясь кислородом, сгорает и образует белый дым – оксид мышьяка (III) As2O3:
Устойчивые формы оксида мышьяка в газовой фазе – сесквиоксид (мышьяковистый ангидрид) As2O3 и его димер As4O6. До 300 о С основная форма в газовой фазе – димер, выше этой температуры он заметно диссоциирован, а при температурах выше 1800 о С газообразный оксид состоит практически из мономерных молекул As2O3.
Газообразная смесь As4O6 и As2O3 образуется при горении As в кислороде, при окислительном обжиге сульфидных минералов As, например арсенопирита, руд цветных металлов и полимерных руд.
При конденсации пара As2O3 (As4O6) выше 310 о С образуется стекловидная форма As2O3. При конденсации пара ниже 310 о С образуется бесцветная поликристаллическая кубическая модификация арсенолит. Все формы As2O3 хорошо растворимы в кислотах и щелочах.
Оксид As(V) (мышьяковый ангидрид) As2O5 – бесцветные кристаллы ромбической сингонии. При нагревании As2O5 диссоциирует на As4O6 (газ) и О2. Получают As2O5 обезвоживанием концентрированных растворов H3AsO4 с последующим прокаливанием образующихся гидратов.
Известен оксид As2O4, получаемый спеканием As2O3 и As2O5 при 280 о С в присутствии паров воды. Известен также газообразный монооксид AsO, образующийся при электрическом разряде в парах триоксида As при пониженном давлении.
При растворении в воде As2O5 образует существующие только в растворе ортомышьяковистую H3AsO3, или As(OH)3, и метамышьяковистую HAsO2, или AsO(OH), кислоты, обладающие амфотерными, преимущественно кислыми, свойствами.
По отношению к кислотам мышьяк ведет себя следующим образом:
— с соляной кислотой мышьяк не реагирует, но в присутствии кислорода образуется трихлорид мышьяка AsCl3:
— разбавленная азотная кислота при нагревании окисляет мышьяк до ортомышьяковистой кислоты H3AsO3, а концентрированная азотная кислота – до ортомышьякой кислоты H3AsO4:
Ортомышьяковая кислота (мышьяковая кислота) H3AsO4*0.5H2O – бесцветные кристаллы; температура плавления – 36 о С (с разложением); растворима в воде (88% по массе при 20 о С); гигроскопична; в водных растворах – трехосновная кислота; при нагревании около 100 о С теряет воду, превращаясь в пиромышьяковую кислоту H4As5O7, при более высоких температурах переходит в метамышьяковую кислоту HAsO3. Получают окислением As или As2O3 концентрированной HNO3. Она легкорастворимая в воде и по силе приблизительно равна фосфорной.
Окислительные свойства мышьяковой кислоты заметно проявляются лишь в кислой среде. Мышьяковая кислота способна окислить HI до I2 по обратимым реакциям:
Ортомышьяковистая кислота (мышьяковистая кислота) H3AsO3 существует только в водном растворе; слабая кислота; получают растворением As2O3 в воде; промежуточный продукт при получении арсенитов (III) и других соединений.
— концентрированная серная кислота реагирует с мышьяком по следующему уравнению c образованием ортомышьяковистой кислоты:
— растворы щелочей в отсутствие кислорода с мышьяком не реагируют. При кипячении мышьяка со щелочами он окисляется в соли мышьяковистой кислоты H3AsO3. При сплавлении со щелочами образуется арсин (мышьяковистый водород) AsH3 и арсенаты (III). Применяют AsH3
для легирования полупроводниковых материалов мышьяком, для получения As высокой чистоты.
Известны неустойчивые высшие арсины: диарсин As2H4, разлагается уже при -100 о С; триарсин As3H5.
Металлический мышьяк легко взаимодействует с галогенами, давая летучие галогениды AsHal3:
AsCl3 – бесцветная маслянистая жидкость, дымящаяся на воздухе, при застывании образует кристаллы с перламутровым блеском.
C F2 образует также и AsF5 — пентафторид – бесцветный газ, растворимый в воде и растворах щелочей (с небольшим количеством тепла), в диэтиловом эфире, этаноле и бензоле.
Порошкообразный мышьяк самовоспламеняется в среде F2 и Cl2.
С S, Se и Te мышьяк образует соответствующие халькогениды:
сульфиды — As2S5, As2S3 ( в природе – минерал аурипигмент), As4S4 (минерал реальгар) и As4S3 (минерал диморфит); селениды – As2Se3 и As4Se4; теллурид – As2Te3. Халькогениды мышьяка устойчивы на воздухе, не растворимы в воде, хорошо растворимы в растворах щелочей, при нагревании – в HNO3. Обладают полупроводниковыми свойствами, прозрачны в ИК области спектра.
С большинством металлов дает металлические соединения – арсениды. Галлия арсенид и индия арсенид – важные полупроводниковые соединения.
Известны многочисленные мышьякорганические соединения. Мышьякорганические соединения содержат связь As-C. Иногда к мышьякорганическим соединениям относят все органические соединения, содержащие As, например эфиры мышьяковистой кислоты (RO)3As и мышьяковой кислоты (RO)3AsO. Наиболее многочисленная группа мышьякорганических соединений – производные As с координационным числом 3. К ней относятся органоарсины RnAsH3-n, тетраорганодиарсины R2As-AsR2, циклические и линейные полиарганоарсины (RAs)n, а также органоарсонистые и диарганоарсинистые кислоты и их производные RnAsX3-n (X= OH, SH, Hal, OR’, NR2’ и др.). Большинство мышьякорганических соединений – жидкости, полиорганоарсины и органические кислоты As – твердые вещества, CH3AsH2 и CF3AsH2 – газы. Эти соединения, как правило, растворимы в органических растворителях, ограничено растворимы в воде, в отсутствие кислорода и влаги сравнительно устойчивы. Некоторые тетраорганодиарсины на воздухе воспламеняются.
http://helpiks.org/9-61722.html
http://for-engineer.info/general/ximicheskie-svojstva-myshyaka.html