Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Сульфид натрия
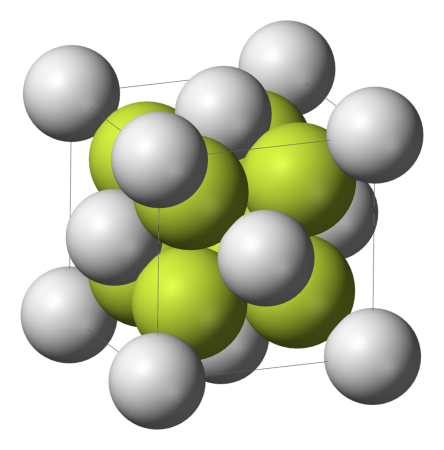
Сульфид натрия, устар. сернистый натрий, — сложное неорганическое вещество с химической формулой Na2S. Содержание
ОписаниеСульфид натрия — бескислородная соль. В обычном состоянии — порошок белого цвета, очень гигроскопичный. Плавится без разложения, термически устойчивый. Технический сульфид натрия желтоватый или коричневатый (красноватый) содержит в себе до 60 % сульфида натрия. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена. ПолучениеВ промышленности — прокаливание минерала мирабилит Na2SO4 · 10H2O. Химические свойстваВзаимодействует с разбавленной соляной кислотой: Взаимодействует с концентрированной серной кислотой: Реагирует с водным раствором перманганата калия: В реакции с йодом оседает чистая сера: ПрименениеСульфид натрия применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии, а так же на хим.водоочистке. Задания 31. Диссоциация электролитов. Реакции ионного обмена.Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: K + + HCO3 — + K + + OH — = 2K + + CO3 2- + H2O Комментарий: формулы слабых кислот, а также формулы водородсодержащих кислотных остатков слабых кислот в ионных уравнениях записываются целиком. Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидрокарбонат натрия, алюминат натрия, бромид калия, углекислый газ, концентрированная серная кислота. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: Комментарий: формулы слабых кислот, а также формулы водородсодержащих кислотных остатков слабых кислот в ионных уравнениях записываются целиком. Для выполнения заданий 30, 31 используйте следующий перечень веществ: азот, хлороводород, оксид фосфора (V), диоксид марганца, ацетат калия. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: CH3COOK + HCl = CH3COOH + KCl CH3COO — + K + + H + + Cl — = CH3COOH + K + + Cl — Комментарий: формулы слабых кислот, а также формулы водородсодержащих кислотных остатков слабых кислот в ионных уравнениях записываются целиком. Для выполнения заданий 30, 31 используйте следующий перечень веществ: серная кислота, оксид серы (VI), гидроксид натрия, бром, силикат натрия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Первый вариант ответа: Комментарий: формулы нерастворимых веществ в ионных уравнениях реакций записывают целиком. Второй вариант ответа: 2Na + + 2OH — + 2H + + SO4 2- = 2Na + + SO4 2- + H2O Комментарий: формулы нерастворимых веществ в ионных уравнениях реакций записывают целиком. Для выполнения заданий 30, 31 используйте следующий перечень веществ: углекислый газ, сульфат натрия, бром, бромоводород, сульфит калия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: 2H + + 2Br — + 2K + + SO3 2- = 2K + + 2Br — + H2O + SO2 Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидрокарбонат кальция, углерод, сульфид меди, азотная кислота, тетрагидроксоалюминат натрия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: Для выполнения заданий 30, 31 используйте следующий перечень веществ: пероксид водорода, фосфат лития, гидрокарбонат калия, гидроксид хрома (III), гидроксид калия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Первый вариант ответа: K + + OH — + K + + HCO3 — = 2K + + CO3 2- + H2O Для выполнения заданий 30, 31 используйте следующий перечень веществ: карбонат натрия, иодоводородная кислота, оксид серы (IV), гидроксид железа (III), хлорид алюминия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: 2H + + 2I — + 2Na + + CO3 2- = 2Na + + 2I — + H2O + CO2 Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфид железа (II), гидроксид натрия, гидроксид алюминия, нитрит натрия, хлорид аммония. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: Na + + OH — + NH4 + + Cl — = Na + + Cl — + NH3 + H2O Для выполнения заданий 30, 31 используйте следующий перечень веществ: иодид натрия, ацетат бария, уксусная кислота, серная кислота, угарный газ. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: Так как в левой и правой частях полного ионного уравнения не обнаруживаются одинаковые ионы, сокращенное ионное уравнение будет совпадать с полным ионным. Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид железа (II), хлорид бария, гидроксид натрия, оксид кремния (IV), концентрированная азотная кислота. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидроксид натрия, дихромат калия, хлорид бария, диоксид кремния, соляная кислота. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: HCl + NaOH = NaCl + H2O H + + Cl — + Na + + OH — = Na + + Cl — + H2O Для выполнения заданий 30, 31 используйте следующий перечень веществ: дихромат калия, сульфат меди, серная кислота, бромид калия, гидроксид алюминия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: Для выполнения заданий 30, 31 используйте следующий перечень веществ: азотная кислота, гидроксид калия, бром, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Первый вариант ответа: Второй вариант ответа: 2K + + 2OH — + 2H + + SO4 2- = 2K + + SO4 2- + 2H2O Третий вариант ответа: Для выполнения заданий 30, 31 используйте следующий перечень веществ: карбонат бария, оксид меди (I), концентрированная серная кислота, гидрокарбонат натрия, дихромат натрия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Первый вариант ответа: Так как в левой и правой частях полного ионного уравнения не обнаруживаются одинаковые ионы, сокращенное ионное уравнение будет совпадать с полным ионным. Второй вариант ответа: Для выполнения заданий 30, 31 используйте следующий перечень веществ: нитрат калия, углекислый газ, алюминий, гидрофосфат калия, гидроксид калия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: K + + OH — + 2K + + HPO4 2- = 3K + + PO4 3- + H2O Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид фосфора (III), азотная кислота, оксид железа (III), оксид серы (IV), карбонат кальция. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидроксид алюминия, сульфат меди (II), нитрат железа (II), концентрированная азотная кислота, гидроксид калия Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Первый вариант ответа: Второй вариант ответа: Fe 2+ + 2NO3 — + 2K + + 2OH — = Fe(OH)2 + 2K + + 2NO3 — Третий вариант ответа: Cu 2+ + SO4 2- + 2K + + 2OH — = Cu(OH)2 + 2K + + SO4 2- Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфат бария, сульфид калия, сульфат натрия, ацетат бария, перманганат калия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Вариант ответа: 2Na + + SO4 2- + 2CH3COO — + Ba 2+ = BaSO4 + 2CH3COO — + 2Na + Для выполнения заданий 30, 31 используйте следующий перечень веществ: раствор серной кислоты, гидроксид меди (II), дихромат калия, диоксид кремния, сульфат железа (II). Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. источники: http://chem.ru/sulfid-natrija.html http://scienceforyou.ru/reshenie-realnyh-zadanij-egje-2016-goda/slozhnye-zadanija-na-reakcii-ionnogo-obmena | ||||||||||||||||||||||||||||||||