Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e021df1ecf19779 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Образование
Помощь в обучении
Сумма коэффициентов в уравнении окислительно восстановительной реакции
Сумма коэффициентов в уравнении окислительно восстановительной реакции
Сумма,или подбор стехиометрических коэффициентов при написании уравнений окислительно-восстановительных реакций основан на равенстве числа электронов,отдаваемых восстановителем и получаемых окислителем.
Искомая сумма вычисляется в несколько этапов.Рассмотрим на примере реакции лабораторного получения хлора окислением хлороводорода HCl перманганатом калия KMnO4,который при этом восстанавливается до иона Mn+2.
1.Уравнения полуреакций в явном виде(при участии молекул воды):
MnO4[-] + 8H[+] + 5e -> Mn[+2] + 4H2O
2.Необходимо уравнять число электронов в обеих полуреакциях,Первое уравнение надо умножить на 2,второе на 5:
2MnO4[-] + 16H[+] + 10e -> 2Mn[+2] + 8H2O
3.Суммируем уравнения и получаем уравнение в ионном виде:
2MnO4[-] + 16H[+] + 10Cl[-] -> 2Mn[+2] + 8H2O + 5Cl2[0]
В конечном уравнении правая часть должна быть равна левой,включая сумму зарядов ионов(в нашем случае +4,так как 16−10−2=2×2).
Оставить ответ Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
СТЕХИОМЕТРИЧЕСКИЕ РАСЧЁТЫ В ХИМИИ
Одним из важнейших химических понятий, на котором основываются стехиометрические расчёты, является химическое количество вещества. Количество некоторого вещества X обозначается n(X). Единицей измерения количества вещества является моль.
Моль – это количество вещества, в котором содержится 6,02·10 23 молекул, атомов, ионов или других структурных единиц, из которых состоит вещество.
Масса одного моля некоторого вещества Х называется молярной массой M(X) этого вещества. Зная массу m(X) некоторого вещества X и его молярную массу, можно рассчитать количество этого вещества по формуле:

Число 6,02·10 23 называется числом Авогадро (Na); его размерность моль –1 .
Умножая число Авогадро Na на количество вещества n(X), можно рассчитать число структурных единиц, например, молекул N(X) некоторого вещества X:
По аналогии с понятием молярной массы ввели понятие молярного объёма: молярный объём Vm(X) некоторого вещества X – это объём одного моля этого вещества. Зная объём вещества V(X) и его молярный объём, можно рассчитать химическое количество вещества:

В химии особенно часто приходится иметь дело с молярным объёмом газов. Согласно закону Авогадро в равных объёмах любых газов, взятых при одной и той же температуре и равном давлении, содержится одно и тоже число молекул. При равных условиях 1 моль любого газа занимает один и тот же объём. При нормальных условиях (н.у.) – температура 0°С и давление 1 атмосфера (101325 Па) – этот объём равен 22,4 л. Таким образом, при н.у. Vm(газа) = 22,4 л/моль. Следует особо подчеркнуть, что величина молярного объёма 22,4 л/моль применяется только для газов.
Знание молярных масс веществ и числа Авогадро позволяет выразить массу молекулы любого вещества в граммах. Ниже приводится пример расчёта массы молекулы водорода.
1 моль газообразного водорода содержит 6,02·10 23 молекул H2 и имеет массу 2 г (т.к. M(H2) = 2 г/моль). Следовательно,
6,02·10 23 молекул H2 имеют массу 2 г;
1 молекула H2 имеет массу x г; x = 3,32·10 –24 г.
Понятие «моль» широко используется для проведения расчётов по уравнениям химических реакций, поскольку стехиометрические коэффициенты в уравнении реакции показывают, в каких молярных соотношениях вещества реагируют друг с другом и образуются в результате реакции.
Например, уравнение реакции 4 NH3 + 3 O2 → 2 N2 + 6 H2O содержит следующую информацию: 4 моль аммиака реагируют без избытка и недостатка с 3 моль кислорода, при этом образуется 2 моль азота и 6 моль воды.
Пример 4.1 Рассчитайте массу осадка, образующегося при взаимодействии растворов, содержащих 70,2 г дигидрофосфата кальция и 68 г гидроксида кальция. Какое вещество останется в избытке? Чему равна его масса?
Из уравнения реакции видно, что 3 моль Ca(H2PO4)2 реагирует с 12 моль KOH. Рассчитаем количества реагирующих веществ, которые даны по условию задачи:
n(KOH) = m(KOH) / M(KOH) = 68 г : 56 г/моль = 1,215 моль.
на 3 моль Ca(H2PO4)2 требуется 12 моль KOH
на 0,3 моль Ca(H2PO4)2 требуется х моль KOH
х = 1,2 моль – столько KOH потребуется, для того чтобы реакция прошла без избытка и недостатка. А по условию задачи имеется 1,215 моль KOH. Следовательно, KOH – в избытке; количество оставшегося после реакции KOH:
n(KOH) = 1,215 моль – 1,2 моль = 0,015 моль;
его масса m(KOH) = n(KOH) × M(KOH) = 0,015 моль × 56 г/моль = 0,84 г.
Расчёт образующегося продукта реакции (осадок Ca3(PO4)2) следует вести по веществу, которое находится в недостатке (в данном случае – Ca(H2PO4)2), так как это вещество прореагирует полностью. Из уравнения реакции видно, что число моль образующегося Ca3(PO4)2 в 3 раза меньше числа моль прореагировавшего Ca(H2PO4)2:
Задание №5
а) Рассчитайте химические количества реагирующих веществ, приведённых в таблице 5 (объёмы газообразных веществ даны при нормальных условиях);
б) расставьте коэффициенты в заданной схеме реакции и по уравнению реакции определите, какое из веществ находится в избытке, а какое в недостатке;
в) найдите химическое количество продукта реакции, указанного в таблице 5;
г) рассчитайте массу или объём (см. таблицу 5) этого продукта реакции.
Таблица 5 – Условия задания № 5
| № варианта | Реагирующие вещества | Схема реакции | Рассчитать |
| m(Fe)=11,2 г; V(Cl2)=5,376 л | Fe+Cl2 ® FeCl3 | m(FeCl3) | |
| m(Al)=5,4 г; m(H2SO4)=39,2 г | Al+H2SO4 ® Al2(SO4)3+H2 | V(H2) | |
| V(CO)=20 л; m(O2)=20 г | CO+O2 ® CO2 | V(CO2) | |
| m(AgNO3)=3,4 г; m(Na2S)=1,56 г | AgNO3+Na2S®Ag2S+NaNO3 | m(Ag2S) | |
| m(Na2CO3)=53 г; m(HCl)=29,2 г | Na2CO3+HCl®NaCl+CO2+H2O | V(CO2) | |
| m(Al2(SO4)3)=34,2 г;m(BaCl2)=52 г | Al2(SO4)3+BaCl2®AlCl3+BaSO4 | m(BaSO4) | |
| m(KI)=3,32 г; V(Cl2)=448 мл | KI+Cl2 ® KCl+I2 | m(I2) | |
| m(CaCl2)=22,2 г; m(AgNO3)=59,5 г | CaCl2+AgNO3®AgCl+Ca(NO3)2 | m(AgCl) | |
| m(H2)=0,48 г; V(O2)=2,8 л | H2+O2 ® H2O | m(H2O) | |
| m(Ba(OH)2)=3,42г; V(HCl)=784мл | Ba(OH)2+HCl ® BaCl2+H2O | m(BaCl2) |
Продолжение таблицы 5
| № варианта | Реагирующие вещества | Схема реакции | Рассчитать |
| m(H3PO4)=9,8 г; m(NaOH)=12,2 г | H3PO4+NaOH ® Na3PO4+H2O | m(Na3PO4) | |
| m(H2SO4)=9,8 г; m(KOH)=11,76 г | H2SO4+KOH ® K2SO4+H2O | m(K2SO4) | |
| V(Cl2)=2,24 л; m(KOH)=10,64 г | Cl2+KOH ® KClO+KCl+H2O | m(KClO) | |
| m((NH4)2SO4)=66 г;m(KOH)=50 г | (NH4)2SO4+KOH®K2SO4+NH3+H2O | V(NH3) | |
| m(NH3)=6,8 г; V(O2)=7,84 л | NH3+O2 ® N2+H2O | V(N2) | |
| V(H2S)=11,2 л; m(O2)=8,32 г | H2S+O2 ® S+H2O | m(S) | |
| m(MnO2)=8,7 г; m(HCl)=14,2 г | MnO2+HCl ® MnCl2+Cl2+H2O | V(Cl2) | |
| m(Al)=5,4 г; V(Cl2)=6,048 л | Al+Cl2 ® AlCl3 | m(AlCl3) | |
| m(Al)=10,8 г; m(HCl)=36,5 г | Al+HCl ® AlCl3+H2 | V(H2) | |
| m(P)=15,5 г; V(O2)=14,1 л | P+O2 ® P2O5 | m(P2O5) | |
| m(AgNO3)=8,5 г;m(K2CO3)=4,14 г | AgNO3+K2CO3®Ag2CO3+KNO3 | m(Ag2CO3) | |
| m(K2CO3)=69 г; m(HNO3)=50,4 г | K2CO3+HNO3®KNO3+CO2+H2O | V(CO2) | |
| m(AlCl3)=2,67 г; m(AgNO3)=8,5 г | AlCl3+AgNO3®AgCl+Al(NO3)3 | m(AgCl) | |
| m(KBr)=2,38 г; V(Cl2)=448 мл | KBr+Cl2 ® KCl+Br2 | m(Br2) | |
| m(CaBr2)=40 г; m(AgNO3)=59,5 г | CaBr2+AgNO3®AgBr+Ca(NO3)2 | m(AgBr) | |
| m(H2)=1,44 г; V(O2)=8,4 л | H2+O2 ® H2O | m(H2O) | |
| m(Ba(OH)2)=6,84 г;V(HI)=1,568 л | Ba(OH)2+HI ® BaI2+H2O | m(BaI2) | |
| m(H3PO4)=9,8 г; m(KOH)=17,08 г | H3PO4+KOH ® K3PO4+H2O | m(K3PO4) | |
| m(H2SO4)=49 г; m(NaOH)=45 г | H2SO4+NaOH ® Na2SO4+H2O | m(Na2SO4) | |
| V(Cl2)=2,24 л; m(KOH)=8,4 г | Cl2+KOH ® KClO3+KCl+H2O | m(KClO3) | |
| m(NH4Cl)=43 г; m(Ca(OH)2)=37 г | NH4Cl+Ca(OH)2®CaCl2+NH3+H2O | V(NH3) | |
| V(NH3)=8,96 л; m(O2)=14,4 г | NH3+O2 ® NO+H2O | V(NO) | |
| V(H2S)=17,92 л; m(O2)=40 г | H2S+O2 ® SO2+H2O | V(SO2) | |
| m(MnO2)=8,7 г; m(HBr)=30,8 г | MnO2+HBr ® MnBr2+Br2+H2O | m(MnBr2) | |
| m(Ca)=10 г; m(H2O)=8,1 г | Ca+H2O ® Ca(OH)2+H2 | V(H2) |
КОНЦЕНТРАЦИЯ РАСТВОРОВ
В рамках курса общей химии студенты изучают 2 способа выражения концентрации растворов – массовая доля и молярная концентрация.
Массовая доля растворённого вещества Х рассчитывается как отношение массы этого вещества к массе раствора:

где ω(X) – массовая доля растворённого вещества X;
m(X) – масса растворённого вещества X;
mраствора – масса раствора.
Массовая доля вещества, рассчитанная по приведённой выше формуле –безразмерная величина, выраженная в долях единицы (0 3 ) раствора
где C(X) – молярная концентрация растворённого вещества X (моль/л);
n(X) – химическое количество растворённого вещества Х (моль);
Vраствора – объём раствора (л).
Пример 5.1 Рассчитайте, молярную концентрацию H3PO4 в растворе, если известно, что массовая доля H3PO4 равна 60%, а плотность раствора – 1,43 г/мл.
По определению процентной концентрации
в 100 г раствора содержится 60 г фосфорной кислоты.
Vраствора = mраствора : ρраствора = 100 г : 1,43 г/см 3 = 69,93 см 3 = 0,0699 л;
Пример 5.2 Имеется 0,5 М раствор H2SO4. Чему равна массовая доля серной кислоты в этом растворе? Плотность раствора принять равной 1 г/мл.
По определению молярной концентрации
в 1 л раствора содержится 0,5 моль H2SO4
(запись «0,5 М раствор» означает, что С(H2SO4) = 0,5 моль/л).
mраствора = Vраствора × ρраствора = 1000 мл × 1 г/мл = 1000 г;
Пример 5.3 Какие объёмы воды и 96% раствора H2SO4 плотностью 1,84 г/мл необходимо взять для приготовления 2 л 60% раствора H2SO4 плотностью 1,5 г/мл.
При решении задач на приготовление разбавленного раствора из концентрированного следует учитывать, что исходный раствор (концентрированный), вода и полученный раствор (разбавленный) имеют различные плотности. В этом случае следует иметь в виду, что Vисходного раствора + Vводы ≠ Vполученного раствора ,
потому что в ходе смешивания концентрированного раствора и воды происходит изменение (увеличение или уменьшение) объёма всей системы.
Решение подобных задач нужно начинать с выяснения параметров разбавленного раствора (т.е. того раствора, который нужно приготовить): его массы, массы растворённого вещества, если необходимо, то и количества растворённого вещества.
Масса раствора, который необходимо приготовить, равна:
M60% р-ра = V60% р-ра ∙ ρ60% р-ра = 2000 мл × 1,5 г/мл = 3000 г.
Масса чистой серной кислоты в приготовленном растворе должна быть равна массе серной кислоты в той порции 96%-го раствора, которую необходимо взять для приготовления разбавленного раствора. Таким образом,
m (H2O) = m40% р-ра – m96% р-ра = 3000 г – 1875 г = 1125 г.
V96% р-ра = m96% р-ра : ρ96% р-ра = 1875 г : 1,84 г/мл = 1019 мл » 1,02 л.
Vводы = mводы : ρводы = 1125г : 1 г/мл = 1125 мл = 1,125 л.
Пример 5.4 Смешали 100 мл 0,1 M раствора CuCl2 и 150 мл 0,2 М раствора Cu(NO3)2 Рассчитать молярную концентрацию ионов Cu 2+ , Cl – и NO3 – в полученном растворе.
При решении подобной задачи на смешивание разбавленных растворов, важно понимать что разбавленные растворы имеют приблизительно одинаковую плотность, примерно равную плотности воды. При их смешивании общий объём системы практически не изменяется: V1 разбавленного раствора + V2 разбавленного раствора +…» Vполученного раствора.
В первом растворе:
n(CuCl2) = C(CuCl2) · Vраствора CuCl2 = 0,1 моль/л × 0,1 л = 0,01 моль;
CuCl2 – сильный электролит: CuCl2 ® Cu 2+ + 2Cl – ;
Поэтому n(Cu 2+ ) = n(CuCl2) = 0,01 моль; n(Cl – ) = 2 × 0,01 = 0,02 моль.
Во втором растворе:
Поэтому n(Cu 2+ ) = n(Cu(NO3)2) = 0,03 моль; n(NO3 – ) = 2×0,03 = 0,06 моль.
После смешивания растворов:
n(Cu 2+ )общ. = 0,01 моль + 0,03 моль = 0,04 моль;
Vобщ. » Vраствора CuCl2 + Vраствора Cu(NO3)2 = 0,1 л + 0,15 л = 0,25 л;
C(Cu 2+ ) = n(Cu 2+ ) : Vобщ. = 0,04 моль : 0,25 л = 0,16 моль/л;
C(Cl – ) = n(Cl – ) : Vобщ. = 0,02 моль : 0,25 л = 0,08 моль/л;
Пример 5.5 В колбу внесли 684 мг сульфата алюминия и 1 мл 9,8% раствора серной кислоты плотностью 1,1 г/мл. Образовавшуюся смесь растворили в воде; объём раствора довели водой до 500 мл. Рассчитать молярные концентрации ионов H + , Al 3+ SO4 2– в полученном растворе.
Рассчитаем количества растворяемых веществ:
Поэтому n(Al 3+ )=2×0,002 моль=0,004 моль; n(SO4 2– )=3×0,002 моль=0,006 моль.
m раствора H2SO4 = V раствора H2SO4 × ρ раствора H2SO4 = 1 мл × 1,1 г/мл = 1,1 г;
Поэтому n(SO4 2– ) = n(H2SO4) = 0,0011 моль; n(H + ) = 2 × 0,0011 = 0,0022 моль.
По условию задачи объём полученного раствора равен 500 мл (0,5 л).
n(SO4 2– )общ. = 0,006 моль + 0,0011 моль = 0,0071 моль.
С(Al 3+ ) = n(Al 3+ ) : Vраствора = 0,004 моль : 0,5 л = 0,008 моль/л;
С(H + ) = n(H + ) : Vраствора = 0,0022 моль : 0,5 л = 0,0044 моль/л;
С(SO4 2– ) = n(SO4 2– )общ. : Vраствора = 0,0071 моль : 0,5 л = 0,0142 моль/л.
Пример 5.6 Какую массу железного купороса (FeSO4·7H2O) и какой объём воды необходимо взять для приготовления 3 л 10% раствора сульфата железа (II). Плотность раствора принять равной 1,1 г/мл.
Масса раствора, который необходимо приготовить, равна:
mраствора = Vраствора ∙ ρраствора = 3000 мл ∙ 1,1 г/мл = 3300 г .
Масса чистого сульфата железа (II) в этом растворе равна:
m(FeSO4) = mраствора × w(FeSO4) = 3300 г × 0,1 = 330 г.
Такая же масса безводного FeSO4 должна содержаться в том количестве кристаллогидрата, которое необходимо взять для приготовления раствора. Из сопоставления молярных масс М(FeSO4·7H2O) = 278 г/моль и М(FeSO4) = 152 г/моль,
в 278 г FeSO4·7H2O содержится 152 г FeSO4;
в х г FeSO4·7H2O содержится 330 г FeSO4;
x = (278·330) : 152 = 603,6 г .
mводы = mраствора – mжелезного купороса = 3300 г – 603,6 г = 2696,4 г.
Т.к. плотность воды равна 1 г/мл, то объём воды, который необходимо взять для приготовления раствора равен: Vводы = mводы : ρводы = 2696,4 г : 1 г/мл = 2696,4 мл.
Пример 5.7 Какую массу глауберовой соли (Na2SO4·10H2O) нужно растворить в 500 мл 10% раствора сульфата натрия (плотность раствора 1,1 г/мл), чтобы получить 15%-ый раствор Na2SO4?
Пусть требуется x граммов глауберовой соли Na2SO4·10H2O. Тогда масса образующегося раствора равна:
m15% раствора = mисходного (10%) раствора + mглауберовой соли = 550 + x (г);
mисходного (10%) раствора = V10% раствора × ρ10% раствора = 500 мл × 1,1 г/мл = 550 г;
Выразим через икс массу чистого Na2SO4, содержащегося в х граммах Na2SO4·10H2O.
Общая масса сульфата натрия в полученном растворе будет равна:
В полученном растворе: 

Далее (таблица 6) приводится перечень задач для самостоятельного решения.
Задание №6
Таблица 6 – Условия задания № 6
| № варианта | Текст условия |
| В воде растворили 5 г Na2SO4×10H2O и объём образовавшегося раствора довели водой до 500 мл. Рассчитайте массовую долю Na2SO4 в этом растворе (ρ = 1 г/мл) и молярные концентрации ионов Na + и SO4 2– . | |
| Смешали растворы: 100 мл 0,05М Cr2(SO4)3 и 100 мл 0,02М Na2SO4. Рассчитайте молярные концентрации ионов Cr 3+ , Na + и SO4 2– в полученном растворе. | |
| Какие объёмы воды и 98%-ного раствора (плотность 1,84 г/мл) серной кислоты нужно взять для приготовления 2 литров 30%-го раствора, плотностью 1,2 г/мл? | |
| В 400 мл воды растворили 50 г Na2CO3×10H2O. Каковы молярные концентрации ионов Na + и CO3 2– и массовая доля Na2CO3 в полученном растворе (ρ=1,1 г/мл)? | |
| Смешали растворы: 150 мл 0,05 М Al2(SO4)3 и 100 мл 0,01 М NiSO4. Рассчитайте молярные концентрации ионов Al 3+ , Ni 2+ , SO4 2- в полученном растворе. | |
| Какие объёмы воды и 60%-го раствора (плотность 1,4 г/мл) азотной кислоты потребуются для приготовления 500 мл 4 М раствора (плотностью 1,1 г/мл)? | |
| Какая масса медного купороса (CuSO4×5H2O) необходима для приготовления 500 мл 5% раствора сульфата меди плотностью 1,05 г/мл? | |
| В колбу внесли 1 мл 36%-ного раствора (ρ = 1,2 г/мл) HCl и 10 мл 0,5 М раствора ZnCl2. Объём образовавшегося раствора довели водой до 50 мл. Каковы молярные концентрации ионов H + , Zn 2+ , Cl – в полученном растворе? | |
| Какова массовая доля Cr2(SO4)3 в растворе (ρ » 1 г/мл), если известно, что молярная концентрация сульфат ионов в этом растворе равна 0,06 моль/л? | |
| Какие объёмы воды и 10 М раствора (ρ=1,45 г/мл) гидроксида натрия потребуются для приготовления 2 л 10% раствора NaOH (ρ= 1,1 г/мл)? | |
| Сколько граммов железного купороса FeSO4×7H2O можно получить, выпарив воду из 10 л 10%-го раствора сульфата железа (II) (плотность раствора 1,2 г/мл)? | |
| Смешали растворы: 100 мл 0,1 М Cr2(SO4)3 и 50 мл 0,2 М CuSO4. Рассчитать молярные концентрации ионов Cr 3+ , Сu 2+ , SO4 2- в полученном растворе. |
Продолжение таблицы 6
| № варианта | Текст условия |
| Какие объёмы воды и 40%-го раствора фосфорной кислоты с плотностью 1,35 г/мл потребуются для приготовления 1 м 3 5%-го раствора H3PO4, плотность которого равна 1,05 г/мл? | |
| В воде растворили 16,1 г Na2SO4×10H2O и объём образовавшегося раствора довели водой до 250 мл. Рассчитайте массовую долю и молярную концентрацию Na2SO4 в образовавшемся растворе (плотность раствора считать равной 1 г/мл). | |
| Смешали растворы: 150 мл 0,05 М Fe2(SO4)3 и 100 мл 0,1 М MgSO4. Рассчитайте молярные концентрации ионов Fe 3+ , Mg 2+ , SO4 2– в полученном растворе. | |
| Какие объёмы воды и 36% соляной кислоты (плотностью 1,2 г/мл) необходимы для приготовления 500 мл 10%-го раствора, плотность которого 1,05 г/мл? | |
| В 200 мл воды растворили 20 г Al2(SO4)3×18H2O. Какова массовая доля растворённого вещества в полученном растворе, плотность которого равна 1,1 г/мл? Рассчитайте молярные концентрации ионов Al 3+ и SO4 2– в этом растворе. | |
| Смешали растворы: 100 мл 0,05 М Al2(SO4)3 и 150 мл 0,01 М Fe2(SO4)3. Рассчитайте молярные концентрации ионов Fe 3+ , Al 3+ и SO4 2– в полученном растворе. | |
| Какие объёмы воды и 80% раствора уксусной кислоты (плотностью 1,07 г/мл) потребуются для приготовления 0,5 л столового уксуса, в котором массовая доля кислоты составляет 7%? Плотность столового уксуса принять равной 1 г/мл. | |
| Какая масса железного купороса (FeSO4×7H2O) необходима для приготовления 100 мл 3% раствора сульфата железа? Плотность раствора равна 1 г/мл. | |
| В колбу внесли 2 мл 36% раствора HCl (плотность 1,2 г/см 3 ) и 20 мл 0,3 М раствора CuCl2. Объём образовавшегося раствора довели водой до 200 мл. Рассчитайте молярные концентрации ионов H + , Cu 2+ и Cl – в полученном растворе. | |
| Чему равна процентная концентрация Al2(SO4)3 в растворе, в котором молярная концентрация сульфат-ионов равна 0,6 моль/л. Плотность раствора 1,05 г/мл. | |
| Какие объёмы воды и 10 М раствора KOH (плотность раствора 1,4 г/мл) потребуются для приготовления 500 мл 10% раствора KOH плотностью 1,1 г/мл? | |
| Сколько граммов медного купороса CuSO4×5H2O можно получить, выпарив воду из 15 л 8% раствора сульфата меди, плотность которого равна 1,1 г/мл? | |
| Смешали растворы: 200 мл 0,025 М Fe2(SO4)3 и 50 мл 0,05 М FeCl3. Рассчитайте молярные концентрацию ионов Fe 3+ , Cl – , SO4 2– в полученном растворе. | |
| Какие объёмы воды и 70% раствора H3PO4 (плотностью 1,6 г/мл) потребуются для приготовления 0,25 м 3 10%-го раствора H3PO4 (плотностью 1,1 г/мл)? | |
| В 100 мл воды растворили 6 г Al2(SO4)3×18H2O. Рассчитайте массовую долю Al2(SO4)3 и молярные концентрации ионов Al 3+ и SO4 2– в полученном растворе, плотность которого равна 1 г/мл. | |
| Смешали растворы: 50 мл 0,1 М Cr2(SO4)3 и 200 мл 0,02 М Cr(NO3)3. Рассчитайте молярные концентрации ионов Cr 3+ , NO3 – , SO4 2- в полученном растворе. | |
| Какие объёмы 50% раствора хлорной кислоты (плотность 1,4 г/мл) и воды необходимы для приготовления 1 литра 8%-го раствора плотностью 1,05 г/мл? | |
| Сколько граммов глауберовой соли Na2SO4×10H2O нужно растворить в 200 мл воды, чтобы получить 5%-ый раствор сульфата натрия? | |
| В колбу внесли 1 мл 80% раствора H2SO4 (плотность раствора 1,7 г/мл) и 5000 мг Cr2(SO4)3. Смесь растворили в воде; объём раствора довели до 250 мл. Рассчитайте молярные концентрации ионов H + , Cr 3+ и SO4 2– в полученном растворе. |
Продолжение таблицы 6
| № варианта | Текст условия |
| Какие объёмы воды и 14 М раствора гидроксида калия (плотность 1,5 г/мл) потребуются для приготовления 500 мл 10% раствора KOH (плотность 1,12 г/мл)? | |
| Рассчитайте молярные концентрации ионов Al 3+ и SO4 2– в 17,1% растворе сульфата алюминия. Плотность раствора принять равной 1,1 г/см 3 . | |
| Сколько граммов кристаллогидрата CaCl2×6H2O нужно добавить к 200 мл 5% раствора хлорида кальция плотностью 1 г/мл, чтобы получить 20% раствор CaCl2? | |
| Какие объёмы воды и 90% раствора фосфорной кислоты (плотность 1,75 г/мл) потребуются для приготовления 500 мл 30% раствора плотностью 1,2 г/мл? |
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Все химические реакции можно разделить на 2 группы: реакции необратимые, т.е. протекающие до полного израсходования хотя бы одного из реагирующих веществ, и реакции обратимые, в которых ни одно из реагирующих веществ не расходуется полностью. Это связано с тем, что обратимая реакция может протекать как в прямом, так и в обратном направлении. Классическим примером обратимой реакции может служить реакция синтеза аммиака из азота и водорода:
В момент начала реакции концентрации исходных веществ в системе максимальны; в этот момент максимальна и скорость прямой реакции. В момент начала реакции в системе ещё отсутствуют продукты реакции (в данном примере – аммиак), следовательно, скорость обратной реакции равна нулю. По мере взаимодействия исходных веществ друг с другом, их концентрации уменьшаются, следовательно, уменьшается и скорость прямой реакции. Концентрация же продукта реакции постепенно возрастает, следовательно, возрастает и скорость обратной реакции. Через некоторое время скорость прямой реакции становится равна скорости обратной. Это состояние системы называется состоянием химического равновесия. Концентрации веществ в системе, находящейся в состоянии химического равновесия, называются равновесными концентрациями. Количественной характеристикой системы в состоянии химического равновесия является константа равновесия.

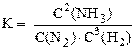
Следует иметь в виду, что в выражение константы равновесия входят равновесные концентрации только газообразных веществ или веществ, находящихся в растворённом состоянии. Концентрация твёрдого вещества считается постоянной и не записывается в выражение константы равновесия.

Существует два наиболее важных типа задач, связанных с расчётом параметров равновесной системы:
1) известны начальные концентрации исходных веществ; из условия задачи можно найти концентрации веществ, прореагировавших (или образовавшихся) к моменту наступления равновесия; в задаче требуется рассчитать равновесные концентрации всех веществ и численную величину константы равновесия;
2) известны начальные концентрации исходных веществ и константа равновесия. В условии нет данных о концентрациях прореагировавших или образовавшихся веществ. Требуется рассчитать равновесные концентрации всех участников реакции.
Для решения подобных задач необходимо понимать, что равновесную концентрацию любого исходного вещества можно найти, отняв от начальной концентрации концентрацию прореагировавшего вещества:
С равновесная = С начальная – С прореагировавшего вещества .
Равновесная концентрация продукта реакции равна концентрации продукта, образовавшегося к моменту наступления равновесия:
С равновесная = С образовавшегося продукта .
Таким образом, для расчёта параметров равновесной системы очень важно уметь определить, сколько к моменту наступления равновесия прореагировало исходного вещества и сколько образовалось продукта реакции. Для определения количества (или концентрации) прореагировавшего и образовавшегося веществ проводятся стехиометрические расчёты по уравнению реакции.
Пример 6.1 Начальные концентрации азота и водорода в равновесной системе N2 + 3H2 ⇆ 2 NH3 соответственно равны 3 моль/л и 4 моль/л. К моменту наступления химического равновесия в системе осталось 70% водорода от его первоначального количества. Определить константу равновесия данной реакции.
Для того чтобы рассчитать константу равновесия, необходимо сначала рассчитать равновесные концентрации всех участников реакции и затем подставить их в выражение константы равновесия.
Из условия задачи следует, что к моменту наступления равновесия прореагировало 30% водорода (задача 1 типа):
Как видно из уравнения реакции, азота должно было вступить в реакцию в 3 раза меньше, чем водорода, т.е. С прореаг.(N2) = 1,2 моль/л : 3 = 0,4 моль/л. Аммиака же образуется в 2 раза больше, чем прореагировало азота:
Собразов.(NH3) = 2 × 0,4 моль/л = 0,8 моль/л
Равновесные концентрации всех участников реакции будут таковы:


Пример 6.2 Рассчитать равновесные концентрации водорода, йода и йодоводорода в системе H2 + I2 ⇆ 2 HI, если известно, что начальные концентрации H2 и I2 равны 5 моль/л и 3 моль/л соответственно, а константа равновесия равна 1.
Следует обратить внимание, что в условии этой задачи (задача 2 типа) в условии ничего не говорится о концентрациях прореагировавших исходных веществ и образовавшихся продуктов. Поэтому при решении таких задач обычно концентрация какого-нибудь прореагировавшего вещества принимается за икс.
Пусть к моменту наступления равновесия прореагировало x моль/л H2. Тогда, как следует из уравнения реакции, должно прореагировать x моль/л I2, и образоваться 2x моль/л HI. Равновесные концентрации всех участников реакции будут таковы:
Далее необходимо подставить выраженные через икс равновесные концентрации в формулу для константы равновесия и решить полученное уравнение.
4x 2 = 15 – 8x + x 2
3x 2 + 8x – 15 = 0
Физический смысл имеет только положительный корень x = 1,27.
Следовательно, Сравн.(H2) = (5 – x) моль/л = 5 – 1,27 = 3,73 моль/л;
Сравн.(I2) = (3 – x) моль/л = 3 – 1,27 = 1,73 моль/л;
Сравн.(HI) = 2x моль/л = 2·1,27 = 2,54 моль/л.
Далее (таблица 7) приводятся условия задач по теме «Химическое равновесие» для самостоятельного решения.
Задание №7
Таблица 7 – Условия задания № 7
| № варианта | Текст условия |
| Начальные концентрации азота и водорода в системе N2 + 3 H2 ⇆ 2 NH3 составляли 4 моль/л и 3 моль/л соответственно. Рассчитайте константу равновесия, если известно, что к моменту наступления равновесия осталось 60% водорода. | |
| Рассчитайте равновесные концентрации всех участников реакции N2+O2 ⇆ 2 NO, если известно, что начальные концентрации кислорода и азота составляли 1 моль/л и 2 моль/л соответственно, а константа равновесия равна 0,5. |
Продолжение таблицы 7
ЧТО ПРОИСХОДИТ, КОГДА МЫ ССОРИМСЯ Не понимая различий, существующих между мужчинами и женщинами, очень легко довести дело до ссоры.
Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам.
Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
http://luxeducation.ru/2018/08/21/summa-koefficientov-v-uravnenii-okislitelno-vosstanovitelnoj-reakcii/
http://zdamsam.ru/a45305.html








