Пируват окисляется до уксусной кислоты
Пировиноградная кислота (ПВК, пируват) является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях пируват симпортом с ионами Н + , движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит коэнзим А.
Пируватдегидрогеназный мульферментный комплекс
Суммарное уравнение отражает окислительное декарбоксилирование пирувата, восстановление НАД до НАДН и образование ацетил-SKoA.
Суммарное уравнение окисления пировиноградной кислоты
Превращение состоит из пяти последовательных реакций, осуществляется мультиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают 3 фермента и 5 коферментов:
- Пируватдегидрогеназа (Е1, ПВК-дегидрогеназа), ее коферментом является тиаминдифосфат (ТДФ), катализирует 1-ю реакцию.
- Дигидролипоат-ацетилтрансфераза (Е2), ее коферментом является липоевая кислота, катализирует 2-ю и 3-ю реакции.
- Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции.
Помимо указанных коферментов, которые прочно связаны с соответствующими ферментами, в работе комплекса принимают участие коэнзим А и НАД.
Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению полученного гидроксиэтила до ацетила и переносу ацетила на коэнзим А (катализируется дигидролипоат-ацетилтрансферазой, Е2).
Реакции синтеза ацетил-SКоА
Оставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в окисленное состояние (катализируются дигидролипоат-дегидрогеназой, Е3). При этом образуется НАДН.
Реакции образования НАДН
Регуляция пируватдегидрогеназного комплекса
Регулируемым ферментом ПВК-дегидрогеназного комплекса является первый фермент – пируватдегидрогеназа (Е1). Два вспомогательных фермента – киназа и фосфатаза обеспечивают регуляцию активности пируватдегидрогеназы путем ее фосфорилирования и дефосфорилирования.
Вспомогательный фермент киназа активируется при избытке конечного продукта биологического окисления АТФ и продуктов ПВК-дегидрогеназного комплекса – НАДН и ацетил-S-КоА . Активная киназа фосфорилирует пируватдегидрогеназу, инактивируя ее, в результате первая реакция процесса останавливается.
Фермент фосфатаза, активируясь ионами кальция или инсулином , отщепляет фосфат и активирует пируватдегидрогеназу.
Регуляция активности пируватдегидрогеназы
Таким образом, работа пируватдегидрогеназы подавляется при избытке в митохондрии (в клетке) ацетил-SКоА и НАДН, что позволяет снизить окисление пирувата и, следовательно, глюкозы в случае когда энергии достаточно.
Если АТФ мало или имеется влияние инсулина, то образуется ацетил-SКоА. Последний в зависимости от условий будет направляться либо в цикл трикарбоновых кислот с образованием энергии АТФ, либо на синтез холестерина и жирных кислот.
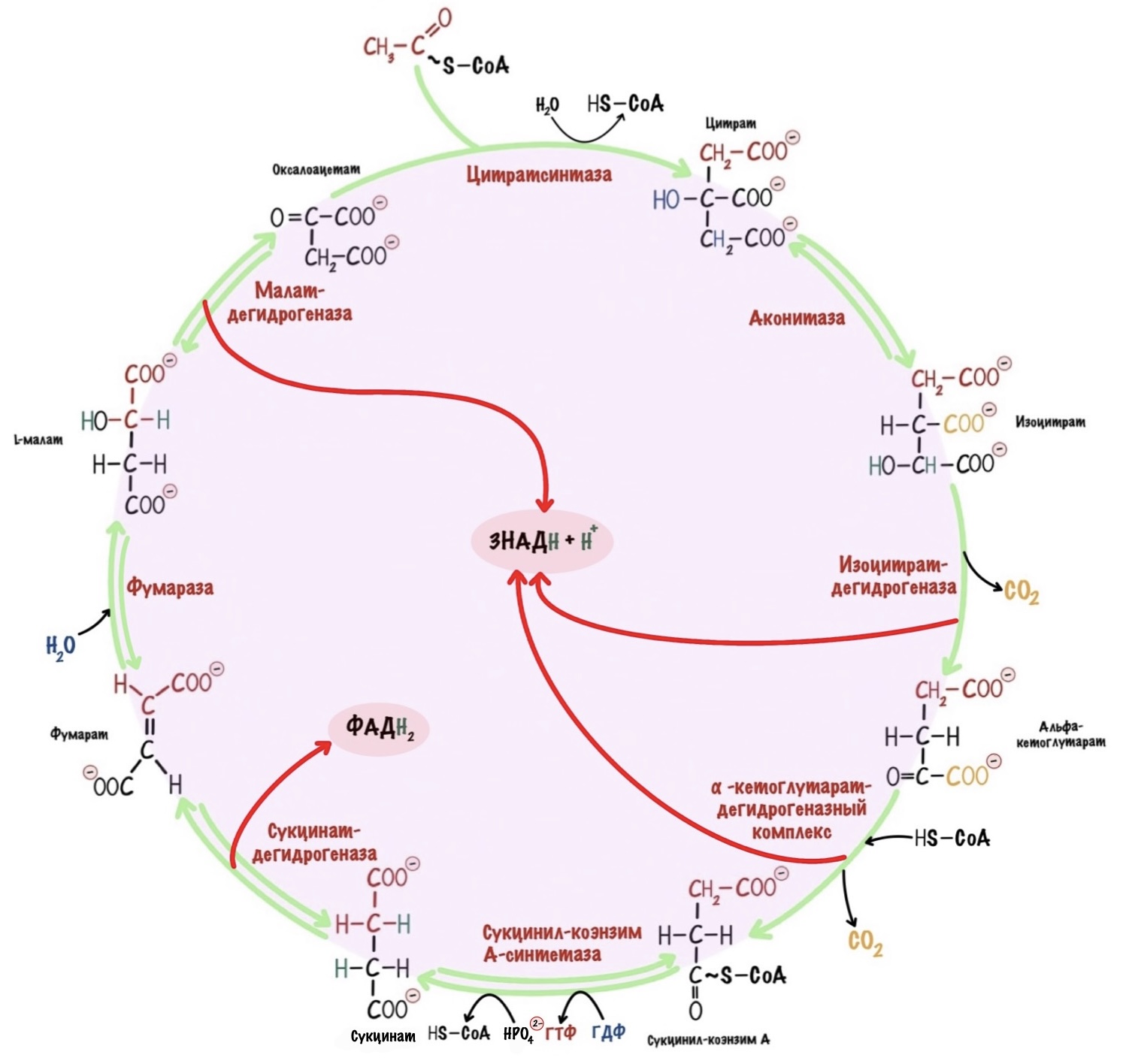
Общий путь катаболизма: окислительное декарбоксилирование пирувата и цикл Кребса
Роль и суть цикла Кребса в катаболизме
У этого цикла есть и другие названия: цикл трикарбоновых кислот и цитратный цикл. Запомнить желательно все. Но какое название самое хорошее? Для меня — цикл трикарбоновых кислот. Просто такое название можно превратить в красивую аббревиатуру — ЦТК. С ней удобно работать. Но самое лучшее для понимания — цитратный цикл. Потому что весь цикл завязан на образовании цитрата. Кребс же открыл этот цикл, поэтому если вы чтите память предков, то называйте его так. Выбирай любое и поехали.
Когда говорят о цикле трикарбоновых кислот, то невольно думаешь: «это что-то с глюкозой и синтезом АТФ». Но это не совсем так, даже совсем не так. Главная роль ЦТК в том, что он объединяет катаболизм жиров, белков и углеводов. Это печь для всех видов дров, которые поступают в наш организм. У него есть и другая роль, но о ней позднее. Пока что разберёмся с печкой.
Дрова должны быть подготовлены к тому, чтобы вступить в ЦТК. Ведь любые ферменты имеют субстратную специфичность. Ферменты цитратного цикла не исключение. В первой реакции этого цикла образуется цитрат. Для его синтеза нужны оксалоацетат и ацетил-коэнзим А — это и есть субстратная специфичность. Другие молекулы в эту реакцию не вступят.
Мы уже знаем кое-что о ЦТК — это цикл. Это значит, что в конце он вернётся к тому, что было в начале: оксалоацетату и ацетил-коэнзиму А. Две молекулы, из них одна должна быть в цикле постоянно, а другая — синтезироваться из жирных кислот, аминокислот и глюкозы. При включении второй молекулы цикл запускается — образуется цитрат. Нам нужно решить, какая молекула будет в цикле постоянно, а какая синтезироваться из белков, жиров и углеводов.
Оксалоацетат можно получить из аминокислот и глюкозы, но вот из жирных кислот невозможно. Ацетил-коэнзим А же можно получить из всех этих молекул. Так что мы приходим к выводу, что оксалоацетат должен всегда быть в цикле, а ацетил-коэнзим А синтезируется из жирных кислот, аминокислот и глюкозы. Ацетил-коэнзим А — это дрова, которые разогревают нашу печь. Отлично!
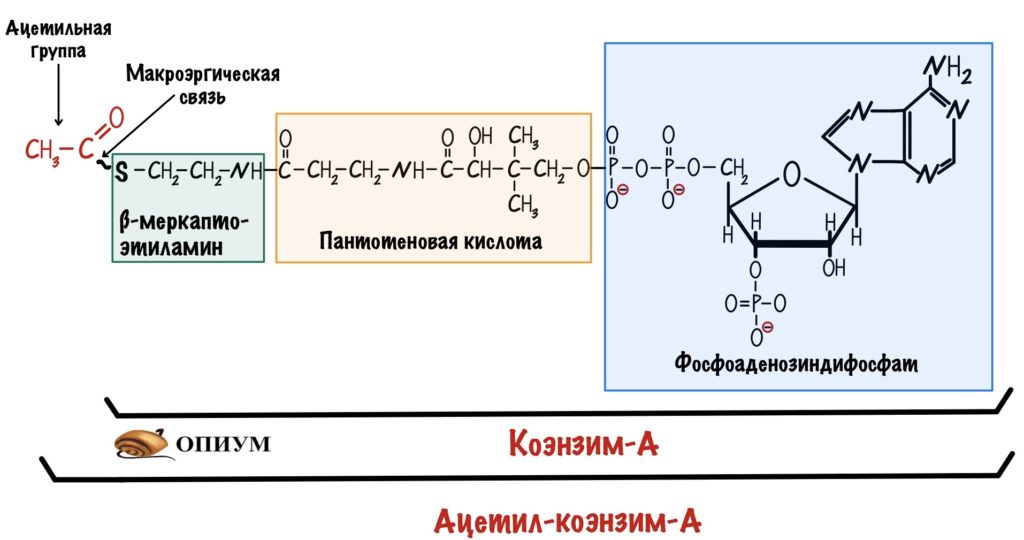
Ацетил-коэнзим А особенная молекула — в ней есть тиоэфирная связь. Эта связь несёт в себе большое количество энергии, которая выделяется при её гидролизе. Такие связи называются макроэргическими и встречаются не так уж и часто. Например, они есть в молекуле АТФ, но там они не тиоэфирные. Кстати, коэнзим А — это производное пантотеновой кислоты (витамин B5). На самом деле формула ацетил-коэнзима А внушительная, но для удобства её сокращают.
Клетка использует ацетил-коэнзим А, потому что у него высокая реакционная способность. Энергия гидролиза тиоэфирной связи будет использована для синтеза цитрата в первой реакции ЦТК.
Откуда берется ацетил-коэнзим А?
Пройдёмся по каждому виду обмена: углеводному, жировому и белковому.
Углеводный обмен. Если вспомнить гликолиз, то в ходе него из глюкозы был получен пируват, а не ацетил-коэнзим А.
Жировой обмен. Жиры состоят из глицерина и жирных кислот. Из жирных кислот образуется ацетил-коэнзим А, но из глицерина его не получить. Глицерин через серию реакций превращается в глицеральдегид-3-фосфат, из которого образуется пируват.
Белковый обмен. С аминокислотами всё сложнее. Часть из них можно превратить в пируват, а другая часть входит в цикл на разных этапах. Сегодня говорим только об аминокислотах, которые образуют пируват.
Мы столкнулись с проблемой, что ацетил-коэнзим А образуется не везде. Кое-где образуется пируват. Не пугаемся — его можно превратить в ацетил-коэнзим А.
Катаболизм белков, жиров и углеводов сводится к образованию ацетил-коэнзима А.
Введём пару понятий. Специфичные пути катаболизма — это реакции, которые ведут к образованию пирувата или ацетил-коэнзима А. Для каждого вида обмена они индивидуальны. Или специфичны.
Общий путь катаболизма — биохимические процессы от образования пирувата/ацетил-конэзима А до синтеза АТФ. Общий путь катаболизма включает три этапа: окислительное декарбоксилирование пирувата, цикл трикарбоновых кислот и окислительное фосфорилирование. Жирным кислотам не нужно декарбоксилирование пирувата, потому что там сразу образуется ацетил-коэнзим А.
Сегодня мы разберёмся с первыми двумя этапами. Вот такая длинная подводка, но нужно было понять, что без образования ацетил-коэнзима А о ЦТК речь идти не может. Теперь ясно, что ЦТК — это не просто какой-то цикл. Его роль просто огромна — объединение всех видов катаболизма.
Развеем ещё один миф про цитратный цикл. Сам по себе ЦТК практически бесполезен. Он не синтезирует АТФ. Да, в ходе его реакций образуются молекулы, которые можно использовать для синтеза других веществ. Например порфиринов, но об этом позднее. Пока что говорим только об его вкладе в синтез АТФ. И какой же это вклад? Чтобы ответить на этот вопрос, нужно докопаться до сути катаболизма.
Суть катаболизма молекул, как и ЦТК, в вытягивании электронов — окислительно-восстановительных реакциях. Клетка пытается выжать из каждой молекулы максимум электронов. Электроны с молекул переносятся на коферменты НАД + и ФАД. При этом НАД + принимает на себя гидрид ион, а ФАД два атома водорода. Зачем? Для того, чтобы отправить их на цепь переноса электронов. Там протекает серия окислительно-восстановительных реакций. Каждая создаёт небольшое количество энергии. Эта энергия используется для создания градиента концентрации протонов. Благодаря градиенту концентрации синтезируется АТФ.
Суть ЦТК в образовании восстановленных коферментов НАДH и ФАДH2. Он делает это через окислительно-восстановительные реакции. А не в синтезе АТФ, как можно подумать. Без цепи переноса электронов ЦТК бесполезен. Справедливо и обратное. Эти два процесса настолько переплетены, что невозможно существование одного без другого. Напоминаю, что речь идёт только про энергетическую роль ЦТК.
Сделаем выводы про ЦТК:
- Его роль в объединении катаболизма белков, жиров и углеводов;
- Его суть в переносе электронов на коферменты НАД + и ФАД. Потом эти электроны будут использоваться цепью переноса электронов для синтеза АТФ.
Теперь можно переходить к реакциям. Начнём с того, что подготовим пируват к цитратному циклу — превратим его в ацетил-коэнзим А.
Окислительное декарбоксилирование пирувата
Реакции образования пирувата проходили в цитоплазме клетки. Общий путь катаболизма идёт в митохондрии. Так что им могут воспользоваться только клетки, в которых есть митохондрии. В эритроцитах их нет, поэтому и ЦТК в них нет.
Пируват транспортируется в матрикс митохондрии с помощью белка переносчика пирувата.
Там его поджидает пируватдегидрогеназный комплекс. Он превратит пируват в ацетил-коэнзим А. По названию этого пункта — окислительное декарбоксилирование пирувата — можно предположить, что произойдёт с пируватом:
- От него отщепится карбоксильная группа;
- При этом будут получены электроны. С помощью окислительно-восстановительной реакции.
Действительно, если посмотреть на неё, то всё так и происходит. Реакция кажется простой.
Но всё совсем не просто. Откуда взялся гидрид ион, который присоединился к НАД + ? Ведь в пирувате нет атомов водорода, которые можно отщепить. Зачем тут столько коферментов? Дело в том, что пируватдегидрогеназный комплекс имеет сложное строение. Он состоит из трёх ферментов и пяти коферментов. Не думайте, что в комплексе только три фермента. Эти три фермента повторяются множество раз. Пируватдегидрогеназный комплекс в 5-6 (!) раз больше рибосомы.
Мы ещё не встречались с такими реакциями, но разобрать их полезно. Хотя бы из-за того, что такая же реакция будет в ЦТК.
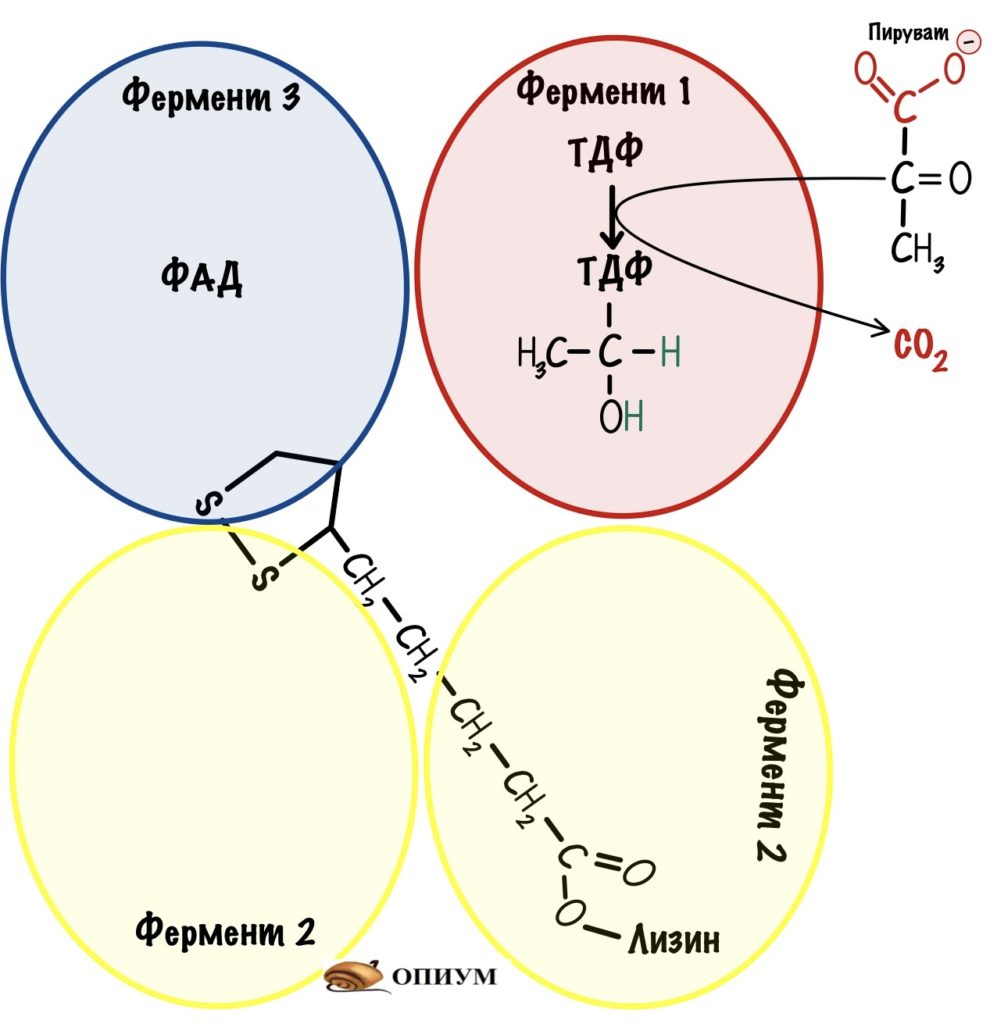
Ферменты и коферменты пируватдегидрогеназного комплекса:
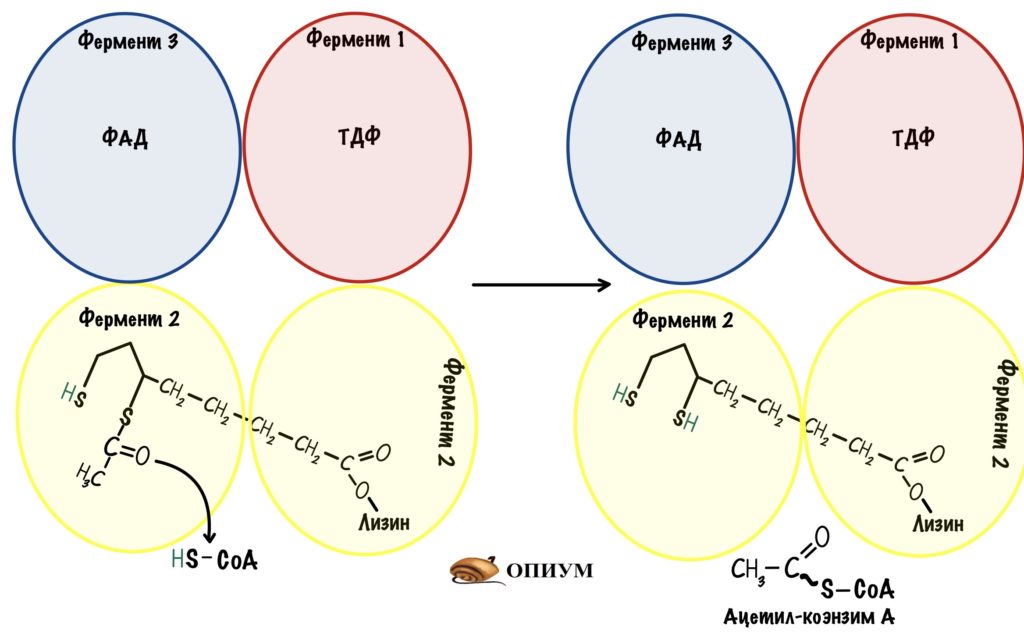
Фермент 1 — пируватдегидрогеназа. Кофермент: тиаминдифосфат (ТДФ);
Фермент 2 — дигидролипоилтрансацетилаза. Коферменты: липоевая кислота и кофермент А. При этом липоевая кислота всегда связана с ферментом через лизин, а вот кофермент А берётся из матрикса;
Фермент 3 — дигидролипоилдегидрогеназа. Коферменты: ФАД и НАД + . ФАД связан с ферментом, а НАД + обитает в матриксе митохондрий.
Пируватдегидрогеназный комплекс катализирует четыре последовательных реакции
Первая реакция — декарбоксилирование. Пируват присоединяется к тиаминдифосфату под действием пируватдегидрогеназны. У тиаминдифосфата есть ионизированный атом углерода. У него высокая реакционная способность, поэтому он может присоединять молекулу пирувата. После этого происходит реакция декарбоксилирования с формированием гидроксиэтил-ТДФ. К молекуле присоединились два протона, которые берутся из матрикса.
Но присоединение возможно только по карбонильному углероду пирувата (второй в молекуле) — без него реакция бы не пошла. Дальше мы поговорим о значении карбонильных и карбоксильных групп.
Вторая реакция — окисление. Гидроксиэтил переносится с ТДФ на липоевую кислоту. При этом в липоевой кислоте разрушается дисульфидный мостик. Один атом серы принимает водород от гидроксиэтила, а второй — ацетильную группу. Здесь произошла окислительно-восстановительная реакция. Атомы серы восстановились, а гидроксиэтил окислился до ацетильной группы. Эту реакцию также катализирует пируватдегидрогеназа.
Липоевая кислота может существовать в трёх формах: окисленной, восстановленной и ацетил-липоата. В этой реакции липоевая кислота из окисленной формы переходит в восстановленную, а затем присоединяет ацетильную группу.
Третья реакция — перенос. Фермент дигидролипоилтрансацетилаза. Она переносит ацетильную группу на -SH группу кофермента А. Мы получили ацетил-коэнзим А и восстановленную форму липоевой кислоты.
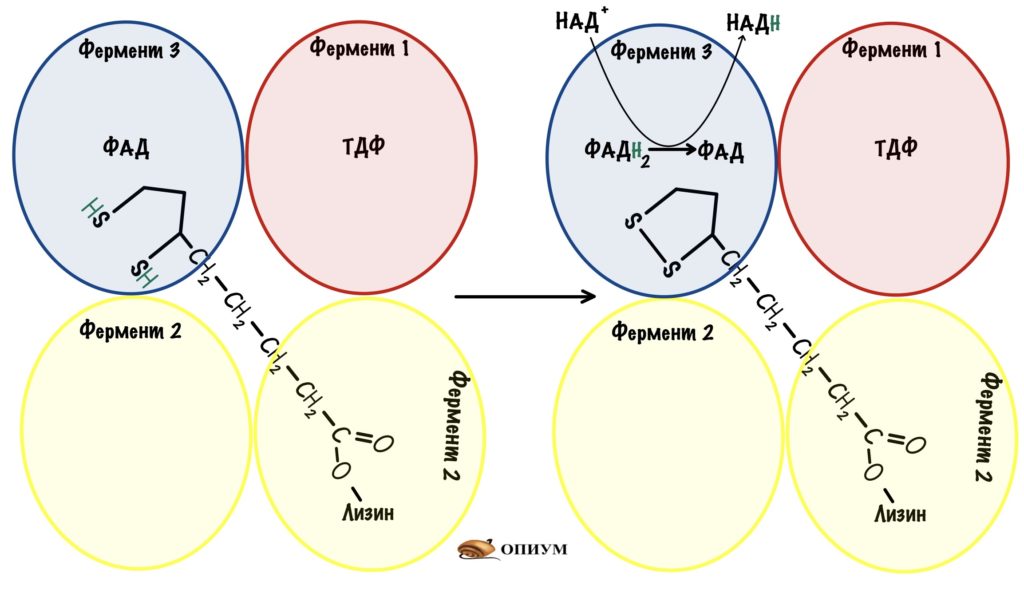
Четвёртая реакция — восстановление. Заметили, что у дигидролипоата больше нет дисульфидного мостика, который был нужен для второй реакции? Да, его нет, а значит нужно восстановить этот мостик. Для этого и нужен третий фермент — дигидролипоилдегидрогеназа. Она переносит два атома водорода на первый кофермент — ФАД. Образуется окисленная липоевая кислота и ФАДH2.
Далее восстанавливается ФАДH2 — он теряет свои два атома водорода. При этом гидрид ион (два электрона и протон) попадают на НАД + , а один протон отправляется в цитоплазму. НАД + окисляется до НАДH. НАДH отдаст свои электроны цепи переноса электронов — произойдёт его восстановление. Цикл может повториться снова.
Сложные реакции, такие писать не очень удобно. Сейчас покажу, как лучше их записать — для этого сопоставим всё вместе. Представим пируватдегидрогеназный комплекс в виде четырёх субъединиц.
Первая субъединица — пируватдегидрогеназа с ТДФ. Вторая субъединица — дигидролипоилтрансацетилаза с липоевой кислотой. Третья — дигидролипоилтрансацетилаза. Четвёртая субъединица — дигидролипоилдегидрогеназа в комплексе с ФАД.
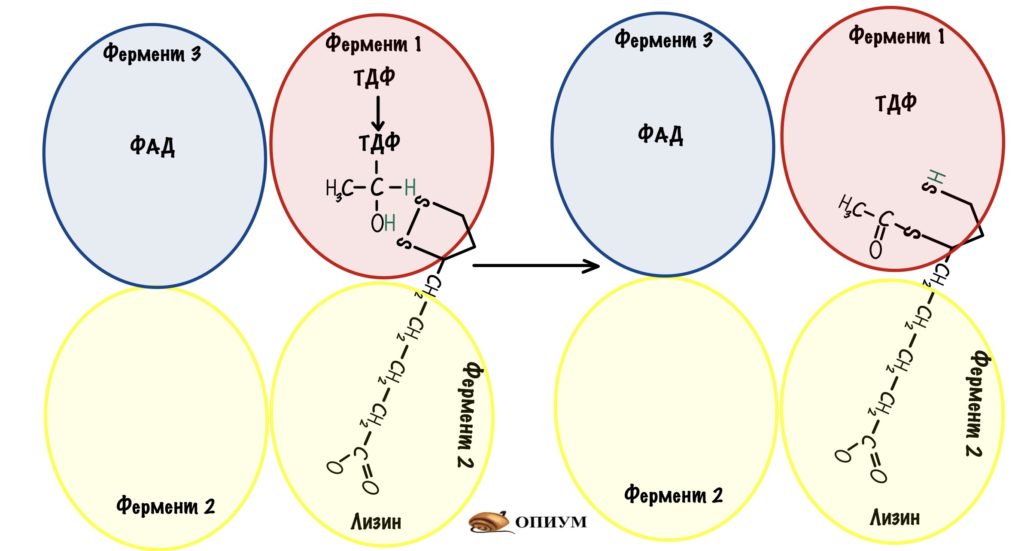
Вторая субъединица связана со всеми остальными с помощью гидрофобных каналов. У неё есть «рука» — это лизин, который связан с липоевой кислотой. Он может раскачиваться и перемещаться от одной субъединицы к другой. Благодаря такому строению комплекс увеличивает свою эффективность — из него не могут вылететь продукты реакции, пока не произойдёт последовательное превращение пирувата в ацетил-коэнзим А, и восстановление всех коферментов.
Пируват присоединяется к ТДФ пируватдегидрогеназы — проходит его декарбоксилирование.
Дальше за дело берётся «рука» дигидролипоилтрансацетилазы. Рука раскачивается и попадает в первую субъединицу. Там пируватдегирогеназа переносит гидроксиэтил на липоевую кислоту. Липоевая кислота становится восстановленной — образовался липоил-ацетил.
Рука снова раскачивается и переносит липоил-ацетил на третью субъединицу. Дигидролипоилтрансацетилаза проводит образование ацетил-коэнзима А — для этой реакции нужен кофермент А. Мы получили то, то хотели — ацетил-коэнзим А.
Но нужно окислить липоевую кислоту, иначе следующий пируват не сможет образовать ацетил-коэнзим А. Для этого рука переносит дигидролипоат на четвертую субъединицу — дигидролипоилдегидрогеназу.
Дигидролипоилдегидрогеназа переводит восстановленную форму липоевой кислоты в окисленную. При этом два атома водорода переносятся на ФАД — образуется ФАДH2. Осталось последнее — восстановить ФАДH2. Дигидролипоилдегидрогеназа переносит гидрид ион на НАД +. Образовался НАДH, который может отдать свои электроны на цепь переноса электронов и восстановиться. Конец — мы можем повторить этот цикл снова.
В ходе работы пируватдегидрогеназного комплекса образуются: ацетил-коэнзим А и НАДH.
Пируватдегидрогеназный комплекс катализирует необратимую реакцию. Мы не можем синтезировать пируват из ацетил-коэнзима А. Это означает, что организм не умеет синтезировать углеводы из жиров. Ведь ацетил-коэнзим А образуется при окислении жирных кислот. При этом ацетил-коэнзим А можно использовать для того, чтобы синтезировать жиры.
Вывод такой: организм умеет синтезировать жиры из углеводов, но не умеет синтезировать углеводы из жиров.
Во время голодания это ему аукается, потому что нашему мозгу нужна глюкоза. А образовать её из жиров он не может. Приходится синтезировать кетонные тела, но они не могут полностью обеспечить мозг энергией. У растений есть специальный путь для синтеза улеводов из жиров, но у нас, увы, нет. Но это так — для общего развития.
Реакции цикла трикарбоновых кислот
Мы подготовили пируват к вступлению в ЦТК, что дальше? Давайте сначала решим такой вопрос — зачем вообще нужен такой сложный цикл. Всё-таки в нём целых восемь реакций! А всё ради того, чтобы окислить два углерода. Как-то не слишком экономно, вам не кажется? Может стоит просто окислить эти два углерода в одну реакцию и дело с концом?
Так делать нельзя. Если бы мы окислили ацетил-коэнзим А, то смогли бы получить только одну молекулу CO2 и метан. Так уж выходит, что организм умеет убирать углерод только с помощью реакций декарбоксилирования. Для этого нужны не только карбоксильные группы, но ещё кое-какие условия. Дальше мы поговорим об этом подробнее. В итоге клетка получит метан, для которого никаких путей метаболизма у нас нет. А вот у бактерий есть!
Организм идёт на хитрость — он делает целых восемь реакций для того, чтобы создать эти самые карбоксильные группы. А затем провести реакции декарбоксилирования с образованием двух молекул углекислого газа. И первая реакция ЦТК основная для создания карбоксильных групп. Так что у этих реакций есть химический смысл. Вообще советую понять смысол всех реакций, так не придётся использовать мнемонические правила и мучаться с запоминанием цикла.
Первая реакция. Образование цитрата.
Оксалоацетат реагирует с ацетил-коэнзимом А — образуется цитрат и коэнзим А, катализатор — цитратсинтаза. Ацетильная группа присоединяется к оксалоацетату. При этом присоединение идёт по первому атому углерода ацетильной группы. Так клетка прячет углерод, который мог превратиться в метан.
Для этой реакции нужно много энергии. Как хорошо, что эта энергия заключена в ацетил-коэнзиме А. Ещё помните про тиоэфирную связь, которая гидролизуется с высвобождением большого количества энергии? Ну и хорошо.
Есть ещё один плюсик — клетка получила коэнзим А, который снова может реагировать с пируватом, либо использоваться для чего-то ещё.
Вторая реакция. Подготовка цитрата к декарбоксилированию.
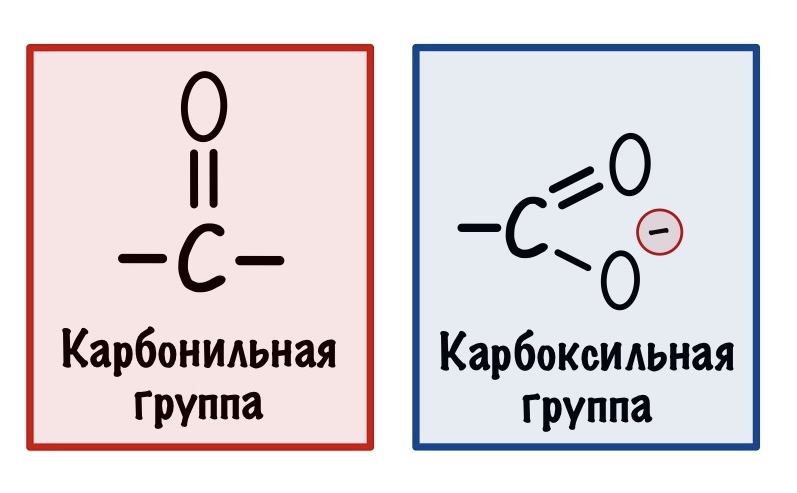
Клетка не может декарбоксилировать цитрат. Сейчас будет немного объяснений с химической точки зрения. Попытаемся разобраться с тем, почему организму так важны карбоксильные и карбонильные группы.
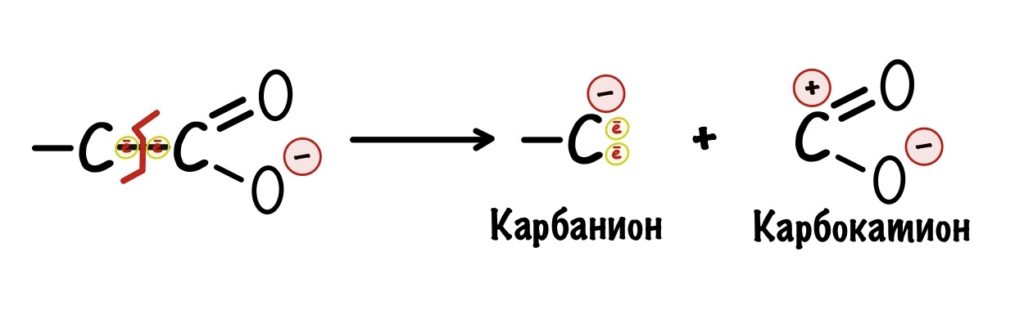
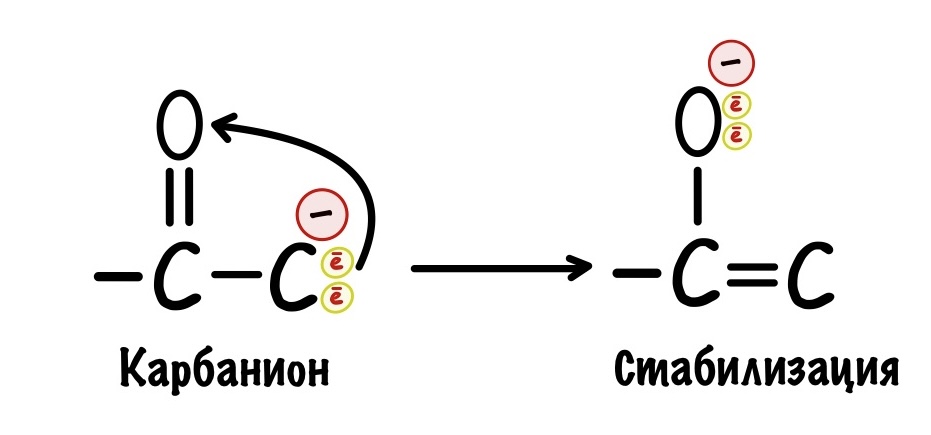
Декарбоксилирование — это отщепление карбоксильной группы, при этом образуется углекислый газ. При декарбоксилировании разрушается ковалентная связь между двумя атомами углерода.
Ковалентная связь образуется за счёт того, что каждый атом углерода даёт по электрону на её образование. Часто, когда ковалентная связь разрушается, то оба электрона остаются у одного атома. Углерод, у которого остались электроны, называется карбанионом. Атом, у которого их отобрали, карбкатионом. У карбаниона отрицательный заряд, а у карбкатиона положительный.
Карбанионы очень нестабильны — у них высокая реакционная способность. Представьте, что мы разрушили связь, но у нас две разноимённые частички — одна с плюсом, а другая с минусом. Они могут сразу же прореагировать (разноимённые заряды притягиваются и всё такое) и снова образовать связь, а нам такое не нужно. Нужно стабилизировать карбанион. Тут появляется карбонильная группа.
В карбонильной группе есть кислород, у которого огромная электроотрицательность. Он может перетащить на себя электроны от карбаниона — при этом между двумя углеродами образуется двойная связь, а кислород становится отрицательным. Так молекула стабилизируется, а значит можно спокойно проводить декарбоксилирование — разноимённые заряды не прореагируют друг с другом.
Как видите карбоксильная и карбонильная группы лежат рядом в этом примере. И это не случайно, если они будут далеко, то кислород не сможет стабилизировать карбанион. Значит они должны быть рядом! Примерно по такому принципу работало декарбоксилирование пирувата.
Вернёмся к нашему цитрату — здесь вообще нет карбонильной группы. Пока что. Но её можно образовать из гидроксильной группы, так что мы не паримся. Если мы создадим карбонильную группу у третьего атома углерода сейчас, то у нас будет пятивалентный углерод, что невозможно. Да и стабилизовать ничего эта карбонильная группа не сможет, поэтому сначала нужно перенести гидроксильную группу на другой атом.
Для этого и нужна вторая реакция, которую катализирует аконитаза. Она проводит реакцию изомеризации — переносит гидроксильную группу на другой атом углерода. Реакция идёт в два этапа: сначала проходит реакция дегидратации с формированием двойной связи, а потом гидролиз. В митохондрии образуется изоцитрат.
Так лучше, теперь мы можем перевести гидроксильную группу в карбонильную. При этом рядом есть карбоксильная группа — у третьего атома углерода. Она будет стабилизироваться карбонильной при реакции декарбоксилирования.
Третья реакция. Декарбоксилирование изоцитрата.
Клетка проводит реакцию образования карбонильной группы и декарбоксилирования в один этап. С помощью фермента — изоцитратдегидрогеназы. Сначала образуется карбонильная группа — это окислительно-восстановительная реакция. При этом НАД + принимает на себя два электрона и протон (гидрид-ион) — образуется НАДH и протон водорода, который остаётся в матриксе. Карбонильная группа стабилизирует карбанион при реакции декарбоксилирования.
Продукт этой реакции — альфа-кетоглутарат. В нём всё ещё есть две карбоксильных группы, но отщепить можно только одну. Вам ничего не напоминает карбоксильная и карбонильная группа снизу молекулы? Очень похоже на пируват, не правда ли? Так и хочется провести окислительное декарбоксилирование, которое мы разбирали выше.
Четвёртая реакция. Декарбоксилирование альфа-кетоглутарата.
Когда разбирали пируватдегидрогеназный комплекс, то я сказал, что по такому же принципу идёт одна из реакций ЦТК. Поздравляю, вы уже знаете эту реакцию! Катализатор — альфа-кетоглутаратдегидрогеназный комплекс, который состоит из трёх ферментов и пяти коферментов. Всё по аналогии с пируватдегидрогеназным. Поэтому не будем на этом останавливаться, просто напишем реакцию в один этап.
Здесь образуется ещё один НАДH и сукцинил-коэнзим А.
Мы избавились от двух атомов углерода, которые вступили в цитратный цикл через ацетил-коэнзим А (вообще от других атомов, как видите красненькие всё еще остаются в молекуле). От обоих с помощью реакций декарбоксилирования. Теперь наша задача вернуться к тому, с чего все начиналось — оксалоацетату. Хорошо, что в молекуле сукцинила-коэнзима А уже четыре атома углерода. Нам нужно только поиграться с ними. Начинаем зацикливаться!
Пятая реакция. Образование сукцината.
В сукцинил-коэнзиме А есть тиоэфирная связь. Напоминаю, что она макроэргическая. Значит её можно использовать для синтеза чего-нибудь. Клетка так и делает, потому что ей не хочется терять энергию просто так. Здесь будет, уже знакомая нам по гликолизу, реакция субстратного фосфорилирования.
Реакция идёт в два этапа. Сначала проходит фосфоролиз тиоэфирной связи с образованием сукцинил-фосфата. Фосфоролиз — это что-то вроде гидролиза, но вместо воды используется неорганический фосфат. Сукцинил-фосфат — это ангидрид из фосфорной и карбоновой кислот, прямо как в гликолизе. У такого ангидрида есть макроэргическая связь. Дальше эта макроэргическая связь гидролизуется, что приводит к образованию энергии. При этом энергия гидролиза идёт на присоединение фосфорной группы к ГДФ. Фермент — сукцинил-коэнзим А-синтетаза. Продукты реакции — сукцинат, коэнзим А и ГТФ.
ГТФ потом можно превратить в АТФ, так что какой-то вклад в образование энергии у ЦТК есть. Получается, что в начале статьи я вас обманул. Но это был такой трюк, чтобы вы заинтересовались!
Коэнзим А можно снова отправить на пируватдегидрогеназный или альфа-кетоглутаратдегидрогеназный комплексы.
Шестая реакция. Образование фумарата.
Мы закончили с декарбоксилированием, но ещё можно вытащить из молекул немного электронов на пути к образованию оксалоацетата.
Что будем делать с сукцинатом для образования оксалоацетата? Для начала нужно присоединить к нему молекулу воды — провести гидроксилирование, но для этого нужна двойная связь. Ну и чего сидим? Давайте делать. Сукцинат-дегидрогеназа отщепляет от сукцината два атома водорода. Для этого нужен кофермент — ФАД. В этой реакции образуется фумарат и ФАДH2.
Сукцинат-дегидрогеназа необычный фермент, даже не из-за того, что использует кофермент ФАД, а все остальные использовали НАД + . Особенность в том, что этот фермент — часть цепи переноса электронов. А если точнее, то второго комплекса цепи переноса электронов. Сукцинат-дегидрогеназа крепится к внутренней мембране митохондрии, а все остальные ферменты просто находятся в матриксе. ФАДH2 сразу отдаёт два атома водорода в дыхательную цепь.
Седьмая реакция. Образование малата.
Теперь проводим гидролиз фумарата. Фермент — фумараза. Вода присоединяется по двойной связи с образованием малата.
У этого фермента есть стереоспецифичность. Строение активного центра таково, что в этой реакции образуется L-малат. Потому что только из него можно образовать оксалоацетат.
Остался последний шаг — провести дегидрирование малата.
Восьмая реакция. Образование оксалоацетата.
В этой реакции получится урвать ещё парочку электронов. Фермент — малатдегидрогеназа, кофермент — НАД + .
Дегидрирование малата приводит к образованию оксалоацетата и НАДH. Мы вернулись к оксалоацетату, поздравляю!
Забыл сказать, все реакции после декарбоксилирования, начиная с пятой, обратимые. Первые, третья и четвёртая реакция — необратимы.
Мы с тобой договорились, что суть ЦТК для катаболизма — перенос электронов на коферменты НАД + и ФАД. Давай суммируем, что он сделал из одной молекулы ацетил-коэнзима А. В ходе третьей, четвертой и восьмой реакции получены по одному НАДH. В ходе шестой реакции — один ФАДH2. Получается, что цитратный цикл вытащил из одной молекулы ацетил-коэнзима А целых восемь электронов! Да, он сделал это не совсем честно. Без оксалоацетата такое количество не получить. Но победителей не судят.
По секрету скажу, что из этих восьми электронов будет синтезировано девять молекул АТФ. Но эта тема останется для цепи переноса электронов.
В ходе ЦТК получены: 3 НАДH и 1 ФАДH2. И, что менее важно для нас, одна молекула ГТФ.
И ещё из интересного. В ходе цикла декарбоксилированы были не атомы углерода из ацетил-коэнзима А, а из оксалоацетата. Проследите за ними на цикле, я отметил их красным цветом. Один атом углерода из ацетил-коэнзима А будет декарбоксилирован в ходе второго цикла, а второй атом в ходе третьего.
Напомню, что ещё одна молекула НАДH была получена в ходе окислительного декарбоксилирования пирувата.
Из одной молекулы пирувата получены: 4 НАДH, 1 ФАДH2 и 1 ГТФ.
Из одной глюкозы образуется два пирувата, поэтому коферменты и ГТФ нужно удвоить.
Анаболическая роль ЦТК
В самом начале статьи был разговор о том, что у ЦТК есть другая роль. А вот и она — анаболическая. В ЦТК восемь реакций. Они нужны не только для получения электронов. Часть молекул из цитратного цикла используются для анаболических процессов. Так что ЦТК — это амфиболический процесс, он сочетает катаболизм и анаболизм.
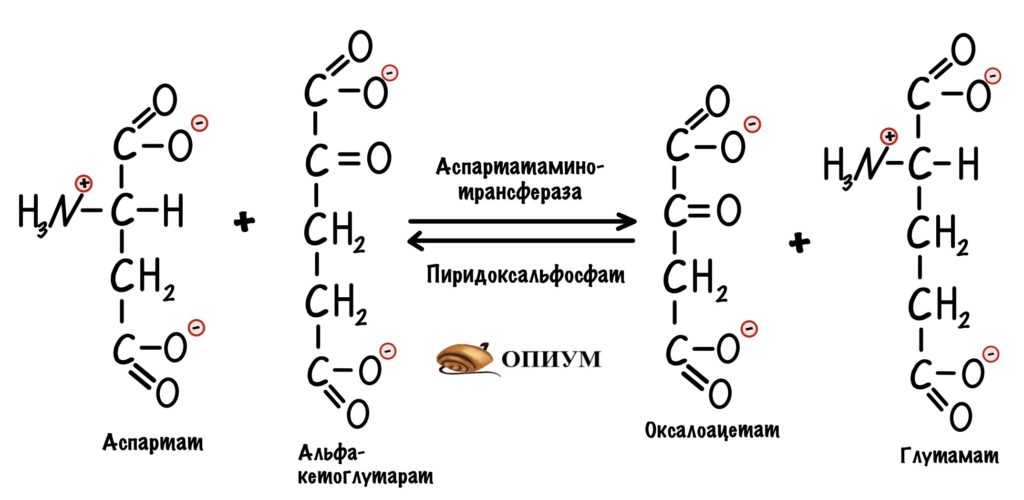
Сейчас разберём пару примеров, в которых цитратный цикл играет анаболическую роль. Начнём с первой реакции — образования цитрата. Нас интересует оксалоацетат, который вступает в неё. Из оксалоацетата можно получить не только цитрат. С помощью реакции трансаминирования оксалоацетата образуется аспартат.
Аспартат используется для синтеза:
Если вспомнить глюконеогенез, то там из оксалоацетата синтезируется фосфоенолпируват. Далее из двух фосфоенолпируватов через серию реакций образуется одна молекула глюкозы.
У фосфоенолпирувата есть и другой анаболический путь. Он может пойти по шагам глюконеогенеза, но остановиться на 3-фосфоглицерате. Из фосфоглицерата через серию реакций образуется серин. А из серина столько всего наворотить можно…
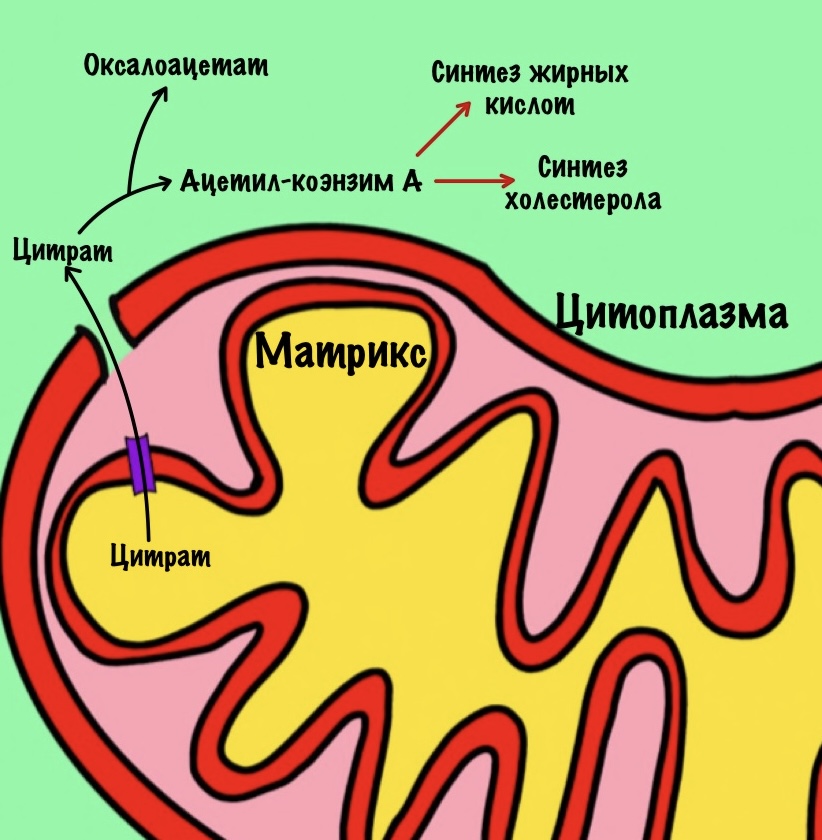
Цитрат. Для синтеза жиров и холестерола нужен ацетил-коэнзим А. Он находится в матриксе митохондрий, а ферменты биосинтеза в цитоплазме. Для ацетил-коэнзима А нет переносчиков во внутренней мембране митохондрий. А для цитрата есть, поэтому сначала ацетил-коэнзим А реагирует с оксалоацетатом. Далее цитрат переносится в цитоплазму, где из него образуются оксалоацетат и ацетил-коэнзим А. Ацетил-коэнзим А пойдет на синтез жирных кислот и холестерола. Из холестерола синтезируются стероидные гормоны.
Альфа-кетоглутарат. С помощью реакции трансаминирования из него образуется глутамат. Из глутамата можно получить гамма-аминомасляную кислоту (ГАМК), глутатион и глутамин. ГАМК — это нейромедиатор в ЦНС. Глутатион используется для реакций дезинтоксикации. А из глутамина синтезируются пурины.
Из глутамата синтезируются другие аминокислоты, например пролин и аргинин. Это опять-таки аминокислоты, использующиеся для синтеза белка.
Сукцинил-коэнзим А. Из сукцинил-коэнзима А синтезируются порфирины — входят в состав гема. Поэтому без него не было бы гемоглобина и миоглобина, а ещё цитохромов.
Вроде всё, но это в общих чертах. Пока что эти реакции вам не нужны, когда дойдёте до каждого вида обмена, то разберётесь с ними подробнее. Этот пунктик нужен был для того, чтобы показать глобальную роль ЦТК. Это не просто цикл для получения восстановленных коферментов НАДH и ФАДH2. Цитратный цикл — источник важнейших прекурсоров для многих видов обмена.
ЦТК — это амфиболический процесс.
Анаплеротические реакции
Если мы забрали какие-то молекулы из ЦТК, то их концентрацию нужно восстановить. Иначе цикл не сможет работать. Реакции, с помощью которых восстанавливаются промежуточные соединения, называются анаплеротическими.
Можно восстановить любой субстрат цикла, потому что дальше он приведёт к образованию оксалоацетата. Это же цикл, правильно? Но таких реакций не слишком много. Выше мы видели, что альфа-кетоглутарат можно получить с помощью реакции трансаминирования. Есть и другие реакции, но на них останавливаться не будем.
Проще восстановить оксалоацетат, потому что в клетке много путей для его образования. В печени и корковом веществе почек оксалоацетат образуется с помощью пируваткарбоксилазы. Мы встречались с этой реакцией в глюконеогенезе.
В сердце и скелетной мускулатуре оксалоацетат образуется из фосфоенолпирувата. Фермент — фосфоенолпируваткарбоксикиназа. В этой реакции разрушается макроэргическая связь фосфоенолпирувата, которая идёт на синтез ГТФ. Это реакция субстратного фосфорилирования. Но для нас важнее восстановить количество оксалоацетата, чем получить энергию.
В большинстве тканей и органов есть малик-фермент. Он катализирует образование малата из пирувата. При этом его кофермент — НАДФH, а не НАДH. Я рассказывал про отличия между ними здесь.
Малат от оксалоацетата отделяет всего одна реакция, которую катализирует малатдегидрогеназа. Мы уже говорили о ней выше.
Регуляция общего пути катаболизма
Осталось поговорить про регуляцию работы пируватдегидрогеназного комплекса и ЦТК. Основная задача для регуляции — поддерживать энергетическое соотношение в клетке. Если в клетке достаточно АТФ, то общий путь катаболизма должен быть отключён. Если концентрация АТФ падает, а нарастает АДФ или АМФ, то нужно запускать общий путь катаболизма.
Основной механизм регуляции пируватдегидрогеназного комплекса и ЦТК — аллостерическая регуляция. Она достаточно быстро и чутко реагирует на изменения энергетического соотношения в клетке. Удивительно, что гормональной регуляции с помощью фосфорилирования/дефосфорилирования здесь нет.
Аллостерическая регуляция — основной способ контроля над общим путём катаболизма. Регуляция идёт по соотношению АТФ к АМФ.
Организм отдал регуляцию общего пути катаболизма на усмотрение клетки. Гликолиз и распад гликогена такого доверия не заслужили. С другой стороны, зачем регулировать каждый этап катаболизма гормонально? Достаточно установить контроль над специфическими путями катаболизма, но я отвлёкся.
Регуляция окислительного декарбоксилирования пирувата
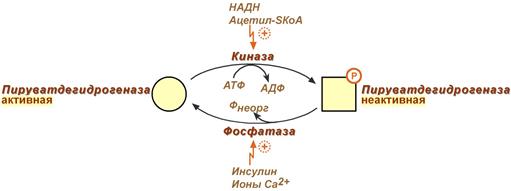
Пируватдегидрогеназный комплекс состоит не только из трёх ферментов и пяти коферментов. С первым ферментом (пируватдегидрогеназой) связаны ещё две белковые субъединицы: киназа и фосфатаза. Киназа фосфорилирует пируватдегидрогеназу по -OH группе — переводит её в неактивную форму. Такое случается при избытке АТФ внутри митохондрии. Отдыхаем после тяжёлого дня, лёжа на диване. Фосфатаза же увеличивает свою работоспособность при снижении концентрации АТФ внутри клетки. Это приводит к дефосфорилированию пируватдегидрогеназы — активация фермента. Бежим за маршруткой — нужна энергия.
Это фофорилирование/дефосфорилирование, но не гормональное. Оно подкрепляет аллостерическую регуляцию. Киназа запускается при избытке АТФ, а фосфатаза при его дефиците. Но давайте перейдём к аллостерической регуляции.
Пируватдегидрогеназный комплекс аллостерически ингибируется: АТФ, НАДH, жирными кислотами, ацетил-коэнзимом А.
Все эти продукты накапливаются, когда клетке не нужна энергия. Понятно дело, что нужно остановить общий путь катаболизма, если в клетке куча АТФ и субстратов для её синтеза.
Пируватдегидрогеназный комплекс аллостерически активируется: АДФ, НАД + , коэнзимом А, кальцием.
С первыми тремя всё ясно — они накапливаются, когда клетке нужна энергия, а её не хватает. Нужно ускорить работу пируватдегидрогеназного комплекса — образовать больше ацетил-коэнзима А. Чем больше ацетил-коэнзима А, тем больше энергии будет получено в ходе ЦТК. А что с кальцием? Кальций работает в мышцах и сердце. При сокращениях небольшая часть кальция попадает в митохондрию. Это стимулирует активность пируватдегидрогеназного комплекса и других ферментов ЦТК — об этом ниже.
Регуляция цикла Кребса
Идёт по трём необратимым реакциям: первой, третьей и четвёртой. Регулируются два фермента и один комплекс: цитратсинтаза, изоцитратдегидрогеназа и альфа-кетоглутаратдегидрогеназный комплекс.
Цитратсинтаза. Аллостерически ингибируется: АТФ, НАДH, цитратом и сукцинил-коэнзимом А. Активируется: АДФ.
Изоцитратдегидрогеназа. Ингибируется: АТФ. Активируется: АДФ и кальцием.
Альфа-кетоглутаратдегидрогеназный комплекс. Ингибируется: НАДH и сукцинил-коэнзим А. Активируется: кальцием.
Видно, что наибольшее количество аллостерических регуляторов у цитратсинтазы и пируватдегидрогеназного комплекса. Это неудивительно, две эти реакции отвечают за старт цикла. Цитратсинтаза ингибируется не только продуктом своей реакции, но и продуктом четвертой реакции — сукцинил-коэнзимом А.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Окислительное декарбоксилирование пирувата.
Раздел 2. Тема 7. Общий путь катаболизма.
Сущность общего пути катаболизма.
Начальные этапы катаболизма (специфические пути катаболизма) основных пищевых веществ (углеводы, белки, жиры) происходят при участии ферментов, специфичных для каждого класса веществ, и завершаются образованием 2 метаболитов — ПВК и уксусной кислоты в форме ацетил-КоА. После образования ПВК дальнейший путь распада веществ до конечных продуктов СО2 и Н2О происходит одинаково в общем пути катаболизма (ОПК, см. рисунок. ).
Ацетил-КоА образуется в специфических реакциях катаболизма жирных кислот и некоторых аминокислот. Но главным источником ацетил-КоА служит пировиноградная кислота, образующаяся в реакциях катаболизма глюкозы и некоторых аминокислот.
Катаболизм основных пищевых веществ. 1-3 — пищеварение; 4-8 — специфические пути катаболизма; 9-10 — общий путь катаболизма; 11 — ЦПЭ; 12 — окислительное фосфорилирование.
Таким образом, общий путь катаболизма включает: 1) окислительное декарбоксилирование пирувата до ацетил-КоА; 2) окисление ацетильной группы ацетил-КоА в цикле трикарбоновых кислот (ЦТК=Цикле Кребса=цикле лимонной кислоты).
Общий путь катаболизма протекает в матриксе митохондрий, реакции являются необратимыми, т.к. происходит уменьшение стандартной свободной энергии.
Строение пируватдегидрогеназного комплекса.
Пируватдегидрогеназный комплекс (ПДК) является классическим мультиферментным комплексом (молекулярная масса более 6×10 6 ), в котором промежуточные продукты остаются связанными на поверхности молекулы фермента до образования конечного продукта. Его концентрация повышена в сердечной мышце, почках.
В состав ПДК входит 3 фермента и 5 кофакторов.
I-й фермент – пируватдегидрогеназа содержит кофактор тиаминпирофосфат (производное витамина В1);
II-й фермент – дигидролипоилтрансацетилаза содержит кофакторы липоевую кислоту (липоамид, ЛК) и кофермент А (НS-КоА);
III-й фермент — дигидролипоилдегидрогеназа содержит кофакторы ФАД + и НАД + .
Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза.
| Фермент | Кофермент | Витамин | |
| 1. Пируватдекарбоксилаза (пируватдегидрогеназа) | Е1 | ТПФ (ТДФ) | Тиамин (B1) |
| 2. Дигидролипоилтрансацетилаза | Е2 | Липоамид | Липоевая кислота (ЛК) |
| KoA | Пантотеновая кислота (В5) | ||
| 3. Дигидролипоилдегидрогеназа | Е3 | FAD + NAD + | Рибофлавин (В2) Никотиновая кислота (РР) |
В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3). Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТПФ, а дигидролипоилдегидрогеназа — FAD. Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные «кронштейны», переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH+Н + ) образование высокоэнергетической тиоэфирной связи в ацетил-КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока — шаперонов, предотвращающих их преждевременный фолдинг (приобретение окончательной нативной конформации) до поступления в митохондриальный матрикс или внутреннюю мембрану митохондрий.
Окислительное декарбоксилирование пирувата.
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н + .
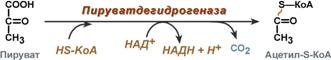
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD + + HS-KoA → CH3-CO ∼SKoA + (NADH + H + ) + CO2
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил-КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н + поступает в среду. Реакция необратима, поскольку ΔG 0′ = -33,5 кДж/моль.
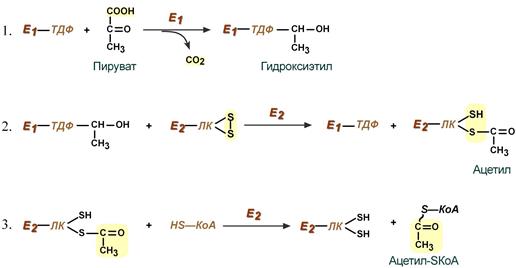
Превращение пирувата в ацетил-КоА включает 5 стадий (см. рисунок ниже).
Стадия I.На этой стадии пируват соединяется с ТПФ в составе Е1 и подвергается декарбоксилированию. В результате двух реакций образуется производное ТДФ с гидроксиэтильной группой — гидроксиэтилтиаминпирофосфат.
Стадия П.Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты (ацитиллипоевая кислота).
Стадия III.На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток (дигидролипоевая кислота).
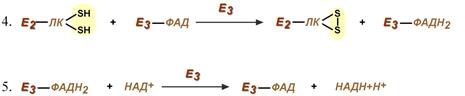
Стадия IV.На стадии IV дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD — простетическую группу фермента Е3.
Стадия V. На стадии V восстановленный FADH2 передаёт водород на NAD + с образованием NADH+Н + .
Окислительное декарбоксилирование пирувата сопровождается образованием NADH+Н + , поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования.
или упрощенная схема (учим по той, которая больше нравится):
http://opiumedu.ru/bihomiya/obshhij-put-katabolizma-okislitelnoe-dekarboksilirovanie-piruvata-i-cikl-krebsa/
http://poisk-ru.ru/s1193t8.html