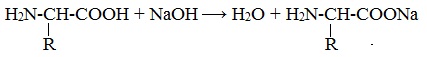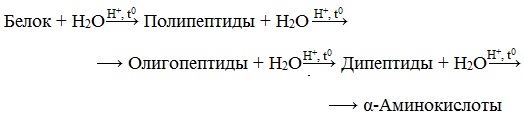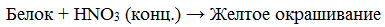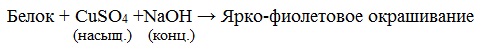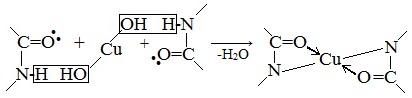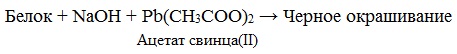Свертывание белка при нагревании уравнение реакции
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
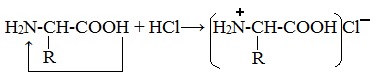
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
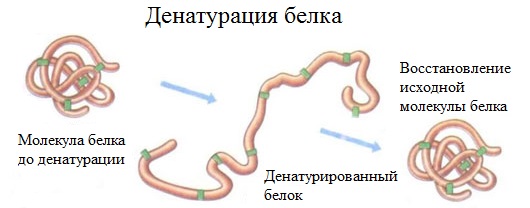
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg 2+ , Pb 2+ , Си 2+ ).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
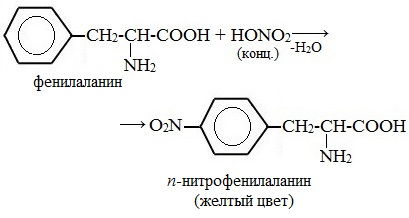
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
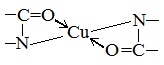
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями.
Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Макромолекулы белков имеют стереорегулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Структуры белков
| Первичная структура — последовательность α-аминокислотных звеньев в полипептидной цепи | Вторичная структура – спиральная структура полипептидной цепи, закрепленная водородными связями между группами N-H и С=О |
 |  |
| Третичная структура – определенная форма спирали в пространстве, образованная с помощью дисульфидных мостиков -S-S-, водородных связей и других взаимодействий | Четвертичная структура — объединение нескольких белковых макромолекул в так называемые глобулы (бывает не у всех белков) |
 |  |
Химические свойства белков
Качественные реакции на белки
- Биуретовая реакция – фиолетовое окрашивание при действии на белки свежеосажденного гидроксида меди (II).
- Ксантопротеиновая реакция – желтое окрашивание при действии на белки концентрированной азотной кислоты.
Денатурация белка
Это разрушение структуры белка при нагревании, изменении кислотности среды, действии излучения, спирта, тяжелых металлов, радиации.
Пример денатурации — свертывание яичных белков при варке яиц.
Денатурация бывает обратимой и необратимой.
- При обратимой денатурации первичная структура белка не разрушается.
- Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
- При необратимой денатурации происходит также гидролиз белка — необратимое разрушение первичной структуры в кислом или щелочномрастворе с образованием аминокислот или более коротких пептидных фрагментов.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Опыт 1. Свёртывание белка при нагревании.
Ход урока.
I. Организационный момент
II. Мотивация и целеполагание
Тема нашего урока: «Денатурация белков. Изменение углеводов»
Закрепление ранее изученных знаний.
Задание № 1. Вопросы по теме: «Кулинарная тепловая обработка».
1. Перечислите основные способы тепловой обработки?
2. Назовите температуру варки основным способом?
3. Назовите комбинированные способы тепловой обработки?
4. Назовите вспомогательные способы тепловой обработки?
5. Назовите температуру пассерования?
Задание № 2. Заполните таблицу: Укажите способы тепловой обработки.
Таблицу чертить не надо, ответы напишите под цифрами 1,2,3,4,5).
| № | Укажите способ тепловой обработки | Процесс |
| обжарка крупно нарезанных овощей без жира (для приготовления бульонов). | ||
| поддержание заданной температуры блюд на раздаче или при доставке к месту потребления. | ||
| припускания предварительно обжаренных продуктов с добавлением пряностей, приправ, бульона или соуса | ||
| припускания продукта в жарочном шкафу с бульоном и затем обжаривание (глазирование). | ||
| обработка продуктов на противнях или сковородах, в жарочном шкафу при температуре 150…270 С. |
III. Изучение нового материала (лекция). Изучение новой темы «Организация Денатурация белков. Изменение углеводов». (Прочитать лекцию, составить конспект, провести первый опыт, приложить к фото отчет).
Прочитать лекцию, составить конспект, ответив на контрольные вопросы.
Вопросы для контроля знаний
1. Что такое денатурация белков?
2. Что такое набухание?
3. Как называется реакция, которая указывает на наличие в белках остатков ароматических аминокислот?
4. При нагревании какой температуры, крахмальные зерна поглощают большое количество воды?
5. Что необходимо использовать для свёртывание белка при нагревании?
V. Подведение итогов. Выставление и комментирование оценок. Что сделали на уроке? Что нового вы получили на уроке?
VI. Домашнее задание. Повторить лекционный материал по опорному конспекту. учебник: Организация работы овощного цеха.
VII. Рефлексия. Мое отношение к уроку. Понравился ли урок? Была ли информация полезна? Какой метод изучения вам понравился?
Тема: Денатурация белков. Изменение углеводов.
Процессы происходящие в белках
Денатурация белков. Это сложный процесс, при котором под влиянием внешних факторов (температуры, механического воздействия, действия кислот, щелочей, ультразвука и др.) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а следовательно, и химический состав белка не меняются.
Денатурация сопровождается изменениями важнейших свойств белка:
— потерей индивидуальных свойств (например, изменение окраски мяса при его нагревании вследствие денатурации миоглобина);
— потерей биологической активности (например, в картофеле, грибах, яблоках и ряде других растительных продуктов содержатся ферменты, вызывающие их потемнение, при денатурации белки-ферменты теряют активность);
— повышением атакуемости пищеварительными ферментами (как правило, подвергнутые тепловой обработке продукты, содержащие белки, перевариваются полнее и легче);
— потерей способности к гидратации (растворению, набуханию);
— потерей устойчивости белковых глобул, которая сопровождается их агрегированием (свертыванием, или коагуляцией, белка).
Процессы происходящие в углеводах
Набухание и клейстеризация крахмала. Набухание — одно из важнейших свойств крахмала, которое влияет на консистенцию, форму, объем и выход готовых изделий.
При нагревании крахмала с водой (крахмальной суспензии) до температуры 50-55°С крахмальные зерна медленно поглощают воду (до 50% своей массы) и ограниченно набухают. При этом повышения вязкости суспензии не наблюдается. Набухание это обратимо: после охлаждения и сушки крахмал практически не изменяется. При нагревании от 55 до 80°С крахмальные зерна поглощают большое количество воды, увеличиваются в объеме в несколько раз, теряют кристаллическое строение, а следовательно, анизотропность.
Опыт 1. Свёртывание белка при нагревании.
Свёртывание белков, т.е. денатурация —процесс утраты белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических реагентов и ряда других факторов) происходит разрушение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а, следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит укрупнение.
Для работы служит белок куриного яйца, растворённый в воде (белок одного яйца на 150 мл воды).
Описание опыта. Небольшое количество раствора белка нагреть на горелке до кипения. Наблюдается помутнение жидкости. Полученный осадок не растворяется ни при охлаждении, ни при разбавлении водой, т.е. реакция является необратимой.
http://chemege.ru/belki/
http://poisk-ru.ru/s20271t21.html