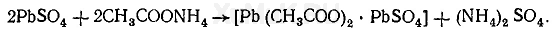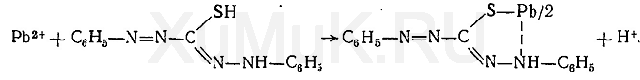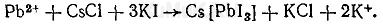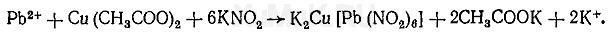Химический анализ (стр. 3 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
3. Реакция с дитизоном (C6H5)2CSN4H2. В нейтральных и слабощелочных растворах дитизон реагирует с ионами свинца, образуя внутрикомплексное соединение красного цвета. Дитизонат свинца нерастворим в воде, но растворим в органических соединениях (CHCl3, CCl4):

Проведению реакции мешают другие катионы, поэтому целесообразно отделить катионы свинца от других, используя хорошую растворимость в горячей воде хлорида свинца.
Методика проведения реакции. В пробирку помещают 2-3 капли исследуемого раствора, добавляют 2 н. раствора NH4OH, доводя рН до 8-10, и 2-3 капли дитизона в CCl4. Смесь сильно встряхивают в течение 30 с. В присутствии свинца зеленая окраска реагента переходит в красную.
Некоторые реакции катионов второй аналитической группы приведены в табл. 6.
Сводная таблица реакций катионов второй аналитической группы
AgCl ↓ белый осадок, растворим в NH4OH, Na2S2O3
Hg2Cl2↓ белый осадок, при действии NH4OH чернеет
PbCl2↓ белый осадок, растворим в горячей воде
AgI ↓ желтый осадок, растворим в Na2S2O3
Hg2I2↓ зеленый осадок, растворим в избытке KI
PbI2 ↓ золотисто-желтый осадок, растворим в избытке KI, CH3COOH
Ag2CrO4 ↓ красно-бурый осадок, растворим в HNO3, NH4OH
Hg2CrO4 ↓ красный осадок, растворим в HNO3
PbCrO4 ↓ желтый осадок, растворим в NaOH, HNO3
Желтое окрашивание хлороформного слоя (рН=7)
Красное окрашивание хлороформного слоя (рН > 7)
Ag2O – буро-черный осадок, растворим в HNO3, NH4OH
Hg – черный осадок, растворим в HNO3
Pb(OH)2 – белый осадок, растворим в NaOH, HNO3
растворим в горячей воде
Hg2SO4 ↓ растворим в царской водке
PbSO4 ↓ растворим в NaOH, HCl, H2SO4
Ag ↓ черный осадок
Hg ↓ черный осадок
Pb ↓ черный осадок
2.3. Третья аналитическая группа катионов
К третьей аналитической группе относят катионы бария, стронция и кальция (Ва2+, Sr2+, Са2+). Их групповым реактивом является разбавленная серная кислота H2SO4, которая осаждает эти катионы в виде белых кристаллических малорастворимых в кислотах и щелочах сульфатов (BaSO4, SrSO4, CaSO4).
Ba2+ + (SO4)2─ = BaSO4(тв);
Sr2+ + (SO4)2─ = SrSO4(тв);
Ca2+ + (SO4)2─ = CaSO4(тв).
Растворимость сульфатов в воде различна: ПРCaSO4 = 2.4∙10-5; ПРSrSO4 = 3.2∙10-7; ПРBaSO4 = 2.1∙10-10. Наименее растворим сульфат бария, поэтому групповым реактивом смеси катионов этой группы он осаждается первым, сульфат стронция — через некоторое время после смешивания реактивов, а сульфат кальция образуется только из насыщенных растворов. Растворимость сульфата кальция существенно снижается в присутствии этилового спирта. Для отделения ионов кальция от остальных катионов третьей группы используют растворимость сульфата кальция в сульфате аммония:
CaSO4 (тв) + (NH4)2SO4 = (NH4)2[Ca(SO4)2].
Труднорастворимы и карбонаты этих ионов. Их произведения растворимости: ПРСаСО3 = 4.8∙10-9; ПРSrСОз = 1 6∙10-9; ПРВаСО3 = 8∙10-9. В ходе анализа сульфаты необходимо перевести в карбонаты. В соответствии с их растворимостью сульфаты кальция и стронция довольно легко переходят в карбонаты, а сульфат бария очень трудно. Для перевода сульфатов бария, кальция и стронция в карбонаты их многократно обрабатывают горячим раствором Na2CO3 или сплавляют с гидрокарбонатом натрия при температуре С:
MeSO4(тв) + Na2CO3 = MeCO3 (тв) + Na2SO4.
Образовавшиеся карбонаты ионов третьей аналитической группы легко растворимы в минеральных кислотах:
MeCO3 + 2H+ = Me2+ + H2O + CO2↑.
В полученном растворе можно специфическими реакциями открывать отдельные катионы данной группы.
2.3.1. Реакции катиона бария
1. Окрашивание пламени. При внесении в пламя горелки летучих солей бария пламя окрашивается в желто-зеленый цвет.
Ba2+ + CrO42- = BaCrO4(тв).
2Ba2+ + Cr2O72- + H2O + 2CH3COO — = 2BaCrO4 (тв) + 2CH3COOH.
Образуется желтый кристаллический осадок хромата бария, растворимый в азотной и соляной кислотах. Реакцию ведут в присутствии уксусной кислоты, которая растворяет хромат стронция SrCrO4 и препятствует его осаждению вместе с хроматом бария.
Методика проведения реакции. К 1-2 каплям раствора, содержащего ионы бария, добавляют 3-4 капли раствора CH3COONa и 1-2 капли раствора дихромата калия. Пробирку нагревают на водяной бане. Образуется желтый кристаллический осадок хромата бария.
3. Реакция с гипсовой водой CaSO4. Образуется белый осадок сульфата бария по реакции:
Ba2+ + CaSO4 = BaSO4(тв) + Ca2+.
2.3.2. Реакции катиона кальция
1. Окрашивание пламени. Пламя горелки при внесении солей кальция окрашивается в кирпично-красный цвет.
2. Реакция с оксалатом аммония (NH4)2C2O4.
Ca2+ + C2O42- = CaC2O4(тв).
Оксалат аммония образует с ионами кальция кристаллический осадок CaC2O4 ∙5H2O. Осадок растворяется в сильных кислотах, но нерастворим в уксусной кислоте (в отличие от оксалатов стронция и бария).
Методика проведения реакции. К 2-3 каплям раствора, содержащего ионы кальция, добавляют 2-3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок. Растворимость осадка проверяют в уксусной, а затем в соляной кислотах.
Ca2+ + [Fe(CN)6]4- + 2NH4OH = Ca(NH4)2[Fe(CN)6] (тв) + 2OH-.
В слабощелочной среде (рН
Методика проведения реакции. На предметном стекле перемешивают 2-3 капли раствора, содержащего ионы кальция, с 2-3 каплями раствора NH4OH, нагревают до 60-700С и добавляют 3 капли раствора гексацианоферрата(II) калия.
4. Микрокристаллоскопическая реакция с серной кислотой H2SO4. В разбавленных растворах ион кальция образует с серной кислотой характерные игольчатые кристаллы CaSO4.2H2O. Мешают проведению реакции ионы Pb2+, Ba2+, Sr2+, если они присутствуют в 10-кратном по отношению к ионам кальция избытке.
Методика проведения реакции. На предметное стекло помещают каплю раствора соли кальция, рядом помещают каплю H2SO4 (1:4). Стеклянной палочкой соединяют капли, дают постоять и рассматривают под микроскопом кристаллы, образовавшиеся по краям капли.
2.3.3. Реакции катиона стронция
1. Окрашивание пламени. Летучие соли стронция окрашивают пламя горелки в карминово-красный цвет.
При проведении этой реакции на фильтровальной бумаге образуется красно-бурое окрашивание осадка родизоната стронция, исчезающее в присутствии соляной кислоты. Если в растворе присутствуют ионы бария, то реакцию проводят, предварительно добавляя хромат-ионы.
Методика проведения реакции. На фильтровальную бумагу наносят каплю раствора хромата калия, затем каплю исследуемого раствора, содержащего ионы стронция. Выдерживают бумагу в течение 2-3 минут и добавляют каплю раствора родизоната натрия. В присутствии ионов стронция бумага окрашивается в буро-красный цвет, при их отсутствии остается желтой.
Некоторые реакции катионов третьей аналитической группы приведены в табл. 7.
Сводная таблица реакций катионов третьей аналитической группы
CaSO4 ↓ белый осадок, растворим в (NH4)2SO4
SrSO4 ↓ белый осадок, растворим в конц. H2SO4
BaSO4 ↓ белый осадок, растворим в конц. H2SO4
SrCrO4 ↓ желтый осадок, растворим в HCl, HNO3, CH3COOH
BaCrO4 ↓ желтый осадок, растворим в HNO3, HCl, нерастворим в CH3COOH
BaCrO4 ↓ желтый осадок, растворим в HNO3, HCl
CaC2O4 ↓ белый осадок, растворим в HCl, HNO3 ,нераств. в CH3COOH (гор.)
SrC2O4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH (гор.)
BaC2O4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH (гор.)
CaHPO4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH
SrHPO4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH
BaHPO4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH
CaCO3 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH
SrCO3 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH
BaCO3 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH
SrSO4 ↓ белый осадок
BaSO4 ↓ белый осадок
CaK2[Fe(CN)6] ↓ белый осадок, растворим в HCl, HNO3
BaK2[Fe(CN)6] ↓ белый осадок, растворим в HCl, HNO3
CaC6O6.Ca(OH)2 ↓ фиолетовый осадок, растворим в HCl
SrC6O6 ↓ красно-бурый осадок, растворим в HCl
BaC6O6 ↓ красно-бурый осадок, краснеет в HCl
2.4. Четвёртая аналитическая группа катионов
К четвёртой аналитической группе относятся катионы Al3+, Zn2+, Cr3+, Sn2+, Sn4+, образующие с избытком щёлочи растворимые гидроксокомплексные соли. Групповой реактив ─ гидроксид натрия NaOH, при действии которого сначала выпадают осадки гидроксидов:
Al3+ + 3OH — = Al(OH)3(тв),
Zn2+ + 2OH — = Zn(OH)2(тв),
Cr3+ + 3OH — = Cr(OH)3(тв),
Sn2+ + 2OH- = Sn(OH)2(тв),
Sn4+ + 4OH- = Sn(OH)4(тв),
Гидроксиды элементов четвертой аналитической группы обладают амфотерными свойствами, поэтому способны растворяться как в щелочах, так и в кислотах. Поэтому в избытке реактива NaOH осадки гидроксидов растворяются:
Al(OH)3(тв) + OH — = [Al(OH)4]-,
Zn(OH)2(тв) + 2OH — = [Zn(OH)4]2-,
Cr(OH)3(тв) + OH — = [Cr(OH)4]-,
Sn(OH)2(тв)+ 2OH — = [Sn(OH)4]2-,
Sn(OH)4(тв) + 2OH — = [Sn(OH)6]2-.
При растворении гидроксидов в кислотах образуются соли катионов четвертой группы:
Al(OH)3(тв) + 3H+ = Al3+ + 3H2O,
Cr(OH)3(тв) + 3H+ = Cr3+ + 3H2O,
Zn(OH)2(тв) + 2H+ = Zn2+ + 2H2O,
Sn(OH)2(тв) + 2H+ = Sn2+ + 2H2O,
Sn(OH)4(тв) + 6HCl = H2[SnCl6] + 4H2O.
Катионы четвертой группы (кроме Аl3+ и Zn2+) имеют переменные степени окисления и легко вступают в окислительно-восстановительные реакции, что и используется при анализе этих ионов.
1. Реакция с ализарином C14H6O2(OH)2. Ион Аl3+ открывают реакцией с ализарином (1,2-диоксиантрахиноном), который в аммиачной среде образует с катионом Аl3+ ярко окрашенный комплекс красного цвета ализаринат алюминия — «алюминиевый лак».
Открытию мешают катионы Cr3+, Zn2+, Sn2+.
Методика проведения реакции. На фильтровальную бумагу наносят каплю раствора, содержащего ионы алюминия, выдерживают ее над парами аммиака и добавляют каплю спиртового раствора ализарина. Бумагу подсушивают, и наблюдают появление красного пятна.
+++2. Реакция с алюминоном [C22H11O9(NH4)3]. Алюминон — аммонийная соль ауринтрикарбоновой кислоты образует с катионом алюминия комплексное соединение красного цвета.
Методика проведения реакции. К 2-3 каплям раствора, содержащего ионы алюминия, добавляют 1-2 капли алюминона и нагревают на водяной бане. Затем добавляют раствор аммиака до появления запаха и 2-3 капли раствора карбоната аммония. Образуются хлопья алюминиевого лака.
2Al2(SO4)3 + 2Co(NO3)2 = 2Co(AlO2)2 + 6SO3 (г) + 4NO2 (г) + O2 (г).
Методика проведения реакции. Реакция проводится на фильтровальной бумаге, которая смачивается раствором соли алюминия, азотной кислотой, подсушивается и после смачивания разбавленным раствором нитрата кобальта сжигается. Полученный пепел окрашен в синий цвет вследствие образования алюмината кобальта — тенаровой сини Co(AlO2)2. Проведению реакции мешают катионы Zn2+, Cr3+, Cu2+, Ni2+.
4. Реакция с 8-оксихинолином C9H6N(ОН). 8-оксихинолин образует с алюминием при рН =4,5-10 внутрикомплексное соединение:
Оксихинолинат алюминия малорастворим в воде, хорошо экстрагируется органическими растворителями (CHCl3, CCl4, спирты, кетоны). Экстракты окрашены в желтый цвет и интенсивно флуоресцируют зеленым светом. Мешают определению ионы Ca2+, Mg2+, Sr2+, Ba2+, Zn2+, Cd2+, Zr(IV), Sn2+, оксихинолинаты которых также флуоресцируют.
Методика проведения реакции. На фильтровальную бумагу наносят каплю раствора, содержащего ионы алюминия, каплю ацетатного буферного раствора (рН = 6,5-9,5) и каплю 0,03%-ного спиртового раствора оксихинолина. В присутствии ионов алюминия влажное пятно в ультрафиолетовом свете имеет зеленое свечение.
2.4.2. Реакции катиона хрома (III)
Растворы солей хрома (III) имеют характерную зелёную окраску.
. 1. Реакция с пероксидом водорода H2O2. При действии окислителей на катион Cr3+ образуются соли хромовой и дихромовой кислот. В кислой среде пероксид водорода окисляет хром (III) до дихромат-иона (раствор оранжевого цвета). Пероксид водорода в щелочной среде окисляет хром (III) до хромат-иона (раствор желтого цвета).
[Cr(OH)4]- + 3H2O2 + 2OH — = 2CrO42- + 8H2O.
Методика проведения реакции. К 3 каплям раствора, содержащего ионы хрома, добавляют 3 капли раствора NaOH, 3 капли раствора H2O2, смесь подогревают. После появления желтой окраски охлаждают, добавляют 5 капель раствора HNO3 для перехода хромата в дихромат (до появления оранжевой окраски), 6 капель смеси эфира с изоамиловым спиртом и 3 капли раствора H2O2. Раствор интенсивно перемешивают. Верхний слой окрашивается в синий цвет вследствие перехода в спиртовоэфирный слой пероксида хрома:
Cr2O72- + 4H2O2 + 2H+ = 2CrO5 + 5H2O.
2. Реакция с бензидином NH2─C6H4─C6H4─ NH2. Бензидин окисляется различными окислителями, в том числе и хромат-ионами, в соединение синего цвета. Прежде чем проводить капельную реакцию, нужно окислить ион Cr3+ в CrO42- пероксидом водорода в щелочной среде.
Методика проведения реакции. К 2-3 каплям раствора соли хрома (III) прибавить раствор щелочи до растворения выпавшего осадка Cr(ОН)3, 2-3 капли 3%-го раствора H2O2 и нагреть, пока окраска из зеленой не перейдет в желтую. На полоску фильтровальной бумаги нанести каплю полученного раствора хромата и каплю бензидина. Появляется синее пятно. Эту реакцию можно использовать для дробного обнаружения Cr3+ в смеси других катионов.
3. Реакция с пероксодисульфатом аммония (NH4)2S2O8. При окислении хрома(III) пероксодисульфатом аммония в кислой среде образуются бихромат-ионы. Для ускорения реакцию проводят в присутствии катализатора — нитрата серебра.
2Cr3+ + 3S2O82- + 7H2O = Cr2O72- + 6SO42- + 14H+.
Методика проведения реакции. К 3 каплям раствора, содержащего ионы Cr3+, добавляют 3 капли HNO3, 2 капли AgNO3 и 4 капли (NH4)2S2O8. Смесь подогревают и наблюдают появление оранжевой окраски.
. 4. Реакция с гидроксидом аммония NH4OH. Растворы аммиака осаждают гидроксид хрома(III) серо-зеленого цвета, растворимый в избытке реагента с образованием комплексного соединения — гидроксида гексааминохрома(III) [Cr(NH3)6](OH)3.
Cr3+ + 3NH4OH = Cr(OH)3 (тв) + 3NH4+,
Cr(OH)3 + 6NH4OH = [Cr(NH3)6](OH)3 + 6H2O.
Методика проведения реакции. К 3 каплям раствора соли хрома добавляют 3 капли раствора гидроксида аммония. После выпадения осадка добавляют 6-8 капель гидроксида аммония.
2.4.3. Реакции катиона цинка
1. Реакция с тетрароданомеркуратом аммония (NH4)2[Hg(SCN)4]. В присутствии соли кобальта выпадает голубой осадок, состоящий из смеси солей Co[Hg(SCN)4] и Zn[Hg(SCN)4]:
Co2+ + [Hg(SCN)4]2- = Co[Hg(SCN)4] (тв) — голубой
Zn2+ + [Hg(SCN)4]2- = Zn[Hg(SCN)4] (тв) — белый
Методика проведения реакции. К 2-3 каплям (NH4)2[Hg(SCN)4] прибавить одну каплю очень разбавленного (0,02%) раствора СоС12. Затем в ту же пробирку добавить 1-2 капли раствора соли цинка и потереть палочкой стенки пробирки. Быстро выпадает осадок, состоящий из смеси солей Co[Hg(SCN)4] голубого цвета и Zn[Hg(SCN)4] белого цвета.
Роль цинка заключается в том, что образуемый им белый осадок как затравка ускоряет выпадение синего осадка соли кобальта. Реакция проводится в слабокислом растворе.
+++2. Реакция с гексацианоферратом(II) калия (желтой кровяной солью) K4[Fe(CN)6]. При проведении реакции в нейтральной или кислой среде образуется осадок двойной соли белого цвета:
Zn2+ + K4[Fe(CN)6] = K2Zn[Fe(CN)6](тв) + 2K+
Методика проведения реакции. В пробирку помещают 3 капли раствора соли цинка, 3 капли раствора гексацианоферрата(II) калия, нагревают и наблюдают образование белого осадка.
3. Реакция с дифенилтиокарбазоном (дитизоном) (C6H5)2CSN4H2. При добавлении раствора дитизона в хлороформе CHCl3 к водному раствору, содержащему ионы цинка, образуется дитизонат цинка, окрашивающий в щелочной среде хлороформный и водный слой в красный цвет. Мешают определению ионы Ag+, Hg2+, Pb2+, Cu2+, Cd2+, Co2+, Ni2+, Bi3+.
Методика проведения реакции. К 3-4 каплям раствора, содержащего ионы цинка, прибавляют 3-4 капли 2 н. раствора NaOH. Каплю полученного щелочного раствора наносят капилляром на фильтровальную бумагу. Пятно обводят по периферии капилляром с раствором дитизона в CCl4. Образуется характерное красное кольцо, которое сравнивают с контрольным опытом. Для этого рядом помещают на бумагу каплю 2 н. NaOH и также обводят ее капилляром с раствором дитизона в CCl4. Образуется оранжевое пятно.
1. Реакция с нитратом висмута Bi(NO3)3. В щелочной среде соли олова (II) восстанавливают катионы Bi3+ до металлического висмута (образуется черный осадок).
Sn2+ + 4OH — = [Sn(OН)4]2-
3[Sn(OН)4]2- + 2Bi3+ + 6OH — = 3[Sn(OН)6]2- + 2Bi(тв).
Методика проведения реакции. К 2 каплям раствора соли олова (II) добавляют по каплям раствор щелочи до растворения образовавшегося вначале осадка гидроксида олова. В чистую пробирку переносят 3 капли полученного раствора, добавляют 2 капли раствора нитрата висмута и наблюдают образование черного осадка.
2. Реакция с сероводородной водой H2S. Сероводород в сильнокислой среде образует с ионами Sn2+ осадок шоколадного цвета, растворимый в концентрированной соляной кислоте с образованием хлоридных комплексов.
Sn2+ + H2S = SnS(тв) + 2H+.
Методика проведения реакции. К 3 каплям раствора, содержащего ионы олова (II), добавляют 3-4 капли сероводородной воды.
3. Реакция с хлоридом ртути(II) HgCl2. Ионы олова (II) в солянокислой среде восстанавливают ионы Hg2+ до Hg22+, при этом образуется белый осадок каломели Hg2Cl2. В избытке ионов олова (II) осадок постепенно чернеет вследствие восстановления до металлической ртути.
SnCl42- + 2HgCl2 = Hg2Cl2(тв) + SnCl62-,
Hg2Cl2(тв) + SnCl2 = 2Hg + SnCl4.
Методика проведения реакции. К 2-3 каплям солянокислого раствора, содержащего ионы олова (II), добавляют 1 каплю раствора нитрата ртути. Выпадает белый шелковистый осадок Hg2Cl2, который при стоянии постепенно чернеет.
4. Реакция восстановления олова(IV) до олова(II) металлами. Ион Sn4+ открывают реакцией восстановления железной стружкой в кислой среде до иона Sn2+:
[SnCl6]2─ + Fe0 = Sn2+ + Fe2+ + 6Cl─.
Методика проведения реакции. К 2-3 каплям солянокислого раствора, содержащего ионы олова (IV), добавляют 1 каплю концентрированной HCl, железные опилки и нагревают до появления пузырьков. Затем раствор сливают в другую пробирку и проводят качественную реакцию на Sn2+ с нитратом висмута.
Некоторые реакции катионов четвертой аналитической группы приведены в табл. 8.
Сводная таблица реакций катионов четвертой аналитической группы
§ 14. СОЕДИНЕНИЯ СВИНЦА
Применение и токсичность соединений свинца. Из различных соединений свинца наибольшее токсикологическое значение имеют арсенат, ацетат, хромат, карбонат, хлорид, нитрат и ряд других солей этого металла.
Оксид свинца применяется для приготовления некоторых красок, входит в состав свинцового пластыря. Карбонат свинца является одним из компонентов свинцовых белил. В состав некоторых красок входит и хромат свинца. Арсенат свинца относится к числу соединений, применяемых для борьбы с вредителями садов и виноградников. Основной ацетат свинца в ряде стран применяется и медицине. Стеарат, олеат и другие соединения свинца с органическими кислотами используются в качестве стабилизаторов при получении пластмасс. Эти соединения используются как сиккативные добавки к краскам, а также входят в состав некоторых помад и жидкостей для волос.
Отмечены случаи бытовых отравлений свинцом, имеющие место при употреблении консервов, изготовленных в недоброкачественно луженной и эмалированной посуде. Большое токсикологическое значение имеет тетраэтилсвинец, токсичность и способы химико-токсикологического исследования которого описаны в гл. IV, § 19.
В промышленных предприятиях, использующих металлический свинец, а также в шахтах, в которых получают свинцовые руды, при недостаточно обеспеченной технике безопасности и охране труда могут быть отравления парами свинца и вдыхаемой пылью. Однако основным источником отравлений соединениями свинца является поступление их в пищевой канал.
Ионы свинца, поступившие в организм, соединяются с сульфгидрильными и другими функциональными группами ферментов и некоторых других жизненно важных белковых соединений. Соединения свинца тормозят синтез порфирина, вызывают нарушение функций центральной и периферической нервной системы. Около 90 % ионов свинца, поступивших в кровь, связываются эритроцитами (по Р. Лудевигу и К. Лосу, 1983).
Соединения свинца выделяются из организма главным образом с калом. Меньшие количества этих соединений выделяются с желчью, а следы — с мочой. Соединения свинца частично откладываются в костной ткани в виде трехзамещенного фосфата. Следует иметь в виду, что незначительные количества свинца содержатся в организме как нормальная составная часть клеток и тканей (см. табл. 7).
Исследование минерализатов на наличие свинца
Для обнаружения свинца в органах трупов, крови, моче и других объектах биологического происхождения используют осадок, который образуется в минерализатах после разрушения биологического материала смесью серной и азотной кислот.
При решении вопроса об отравлении тетраэтилсвинцом (C 2 H 5 ) 4 Pb применяют специальную методику, основанную на изолировании этого препарата перегонкой с водяным паром (см. гл. IV, § 19).
После разрушения биологического материала смесью серной и азотной кислот свинец выпадает в минерализате в виде белого осадка сульфата свинца. Такого же цвета осадок сульфата бария образуется при отравлении соединениями бария. В результате соосаждения осадки сульфатов свинца и бария могут быть загрязнены ионами кальция, хрома, железа и др. При наличии хрома в осадке он имеет грязно-зеленую окраску. Для освобождения осадков сульфатов свинца и бария от примесей эти осадки промывают серной кислотой и водой, а затем осадок сульфата свинца растворяют в подкисленном растворе ацетата аммония:
Ход анализа на наличие свинца зависит от величины осадков, находящихся в минерализатах.
Исследование относительно больших осадков сульфата свинца
При наличии больших осадков сульфата свинца (свыше 2 мг этого вещества) их отделяют от минерализата путем фильтрования или центрифугирования. Отфильтрованный осадок промывают 15—20 мл 0,2 н. раствора серной кислоты, а затем 10 мл воды. После этого осадок на фильтре 3 раза обрабатывают горячим подкисленным раствором ацетата аммония и поступают так, как описано выше (см. гл. VI, § 13). При обработке осадков сульфатов свинца и бария подкисленным раствором ацетата аммония осадок сульфата бария остается на фильтре, а образовавшийся ацетат свинца переходит в фильтрат.
Раствор, содержащий ацетат свинца, доводят до рН = 5 (по универсальному индикатору) с помощью 10 %-го раствора аммиака и в полученном растворе определяют наличие ионов свинца при помощи реакций с иодидом калия, хроматом калия, сероводородной водой и серной кислотой.
Реакция с иодидом калия. В пробирку вносят 0,5 мл исследуемого раствора и несколько капель 5%-го раствора иодида калия. При наличии ионов свинца выпадает желтый осадок PbI 2, который растворяется при нагревании и вновь появляется в виде желтых пластинок при охлаждении раствора. При выполнении этой реакции следует избегать избытка реактива, в котором растворяется иодид свинца и образуется K 2 [PbI 4 ]. Предел обнаружения: 60 мкг свинца в пробе.
Реакция с хроматом калия. К 0,5 мл исследуемого раствора прибавляют 3—5 капель 5%-го раствора хромата калия. Образование оранжево-желтого осадка хромата бария указывает на наличие ионов свинца в растворе. Предел обнаружения: 2 мкг свинца в пробе.
Реакция с сероводородной водой. К 0,5 мл исследуемого раствора прибавляют 3—5 капель свежеприготовленной сероводородной воды. Появление черного осадка сульфида свинца (или мути) указывает на наличие ионов свинца в растворе. Предел обнаружения: 6 мкг свинца в пробе.
Реакция с серной кислотой. 0,5 мл исследуемого раствора вносят в пробирку и прибавляют 5 капель 10 %-го раствора серной кислоты. Появление белого осадка указывает на наличие ионов свинца в растворе. Предел обнаружения: 0,2 мг ионов свинца в пробе.
Исследование малых осадков сульфата свинца
При наличии в минерализате небольшого белого осадка (до 2 мг свинца) его отделяют от жидкости фильтрованием или центрифугированием. Осадок промывают 15—20 мл 0,2 н. раствора серной кислоты, а затем 10 мл воды. Промытый осадок 2—3 раза обрабатывают горячим подкисленным раствором ацетата аммония (см. гл. VI, § 13). Общий объем употребляемого при этом раствора ацетата аммония не должен превышать 2 мл. При обработке осадка раствором ацетата аммония растворяется сульфат свинца (образуется ацетат свинца), а осадок сульфата бария остается на фильтре.
Выделение ионов свинца из минерализата. К раствору, содержащему ацетат свинца, прибавляют хлороформный раствор дитизона и взбалтывают. При этом образуется однозамещенный дитизонат свинца Pb(HDz) 2, хлороформный раствор которого имеет оранжево-красную окраску:
Для маскировки мешающих ионов прибавляют цианид калия (осторожно — яд!) или гидроксиламин. Образовавшийся в хлороформной фазе однозамещенный дитизонат свинца разлагают азотной кислотой. При этом образуется нитрат свинца, который переходит в водную фазу, а дитизон остается в хлороформе, окрашивая его в зеленый цвет. В водной фазе (реэкстракте) определяют наличие ионов свинца с помощью реакций с хлоридом цезия, ацетатом меди и др.
Переведение ионов свинца в дитизонат и разложение дитизо-ната азотной кислотой производится таким образом: исследуемый раствор, содержащий ацетат свинца, вносят в делительную воронку, прибавляют 1 мл 10 %-го раствора гидроксиламина гидрохлорида (но не сульфата) и 3 н. раствор аммиака до рН = 8 (по универсальному индикатору). После этого в делительную воронку вносят 3 мл хлороформа, несколько капель 0,01 %-го раствора дитизона в хлороформе (см. Приложение 1, реактив 12) и взбалтывают. При наличии ионов свинца в исследуемом растворе зеленая окраска хлороформного слоя переходит в красную или в оранжево-красную (образуется дитизонат). Хлороформный слой отделяют от водной фазы, к которой снова прибавляют 3 мл хлороформа и несколько капель 0,01 %-го раствора дитизона в хлороформе. Содержимое делительной воронки взбалтывают, а затем отделяют хлороформный слой. Взбалтывание водной фазы с новыми порциями хлороформа (по 3 мл) и 0,01 %-м раствором дитизона проводят до тех пор, пока хлороформный слой не перестанет изменять зеленую окраску на красную или оранжево-красную.
Окрашенные хлороформные вытяжки, содержащие дитизонат свинца, соединяют и переносят в делительную воронку, в которую для промывания этих вытяжек прибавляют 10 мл смеси, состоящей из равных объемов 0,5 %-го раствора цианида калия и 0,3 н. раствора аммиака, а затем взбалтывают. При наличии ионов свинца хлороформный слой сохраняет оранжево-красную окраску.
Для подтверждения наличия дитизоната свинца в хлороформном слое его отделяют от водной фазы и переносят в делительную воронку, в которую прибавляют 2 мл 1 н. раствора азотной кислоты и взбалтывают. При этом в водную фазу(реэкстракт) переходят ионы свинца, а дитизон остается в хлороформном слое, окрашивая его в зеленый цвет. От хлороформного слоя отделяют водную фазу и определяют в ней наличие иоиов свинца при помощи описанных ниже реакций.
Реакция с хлоридом цезия и иодидом калия. На предметное стекло наносят 4—5 капель водной фазы, которую выпаривают на небольшом пламени. На сухой остаток наносят 2—3 капли 30%-го раствора уксусной кислоты. С одного края жидкости помещают 2—3 кристаллика хлорида цезия, а с противоположного — несколько кристалликов иодида калия. При наличии ионов свинца образуются желто-зеленые игольчатые кристаллы, собранные в виде сфероидов:
Предел обнаружения: 0,01 мкг свинца в пробе.
Реакция с ацетатом меди и нитритом калия. На предметное стекло наносят несколько капель водной фазы, которую на небольшом пламени выпаривают досуха. На сухой остаток наносят 1—2 капли 1 %-го раствора ацетата меди и выпаривают досуха. К сухому остатку прибавляют 2—3 капли 30 %-го раствора уксусной кислоты, а затем на край жидкости вносят несколько кристалликов нитрита калия. Образование черных или коричневых кристалликов, имеющих форму куба, указывает на наличие ионов свинца в водной фазе:
Предел обнаружения: 0,01 мкг свинца в пробе.
Реакции образования осадков. Оставшуюся водную фазу используют для обнаружения ионов свинца при помощи реакций образования осадков с иодидом калия, хроматом калия, сероводородной водой и серной кислотой. Выполнение этих реакций описано выше.
Группа «металлических» ядов. Дробный (химический) метод анализа
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Глава 10. Группа «металлических» ядов
10.1. Понятие об атомно-абсорбционной спектрометрии
10.2 Понятие об атомно-флуоресцентном анализе
10.3. Понятие об атомно-эмиссионном анализе
10.4. Понятие о рентгено-флуоресцентном анализе
10.5. Дробный (химический) метод анализа «металлических» ядов в минерализате
- 10.5.1. Соединения свинца
- 10.5.2 Соединения бария
- 10.5.3. Соединения марганца
- 10.5.4. Соединения хрома
- 10.5.5. Соединения серебра
- 10.5.6. Соединения мышьяка
- 10.5.7. Соединения меди
- 10.5.8. Соединения висмута
- 10.5.9. Соединения цинка
- 10.5.10. Соединения сурьмы
- 10.5.11. Соединения таллия
- 10.5.12. Соединения кадмия
- 10.5.13. Соединения ртути
Глава 10. ГРУППА «МЕТАЛЛИЧЕСКИХ» ЯДОВ
В группу «металлических» ядов объединены соединения неорганических веществ, имеющих токсикологическое значение. К ним относят соли и оксиды металлов, а также соединения сурьмы и мышьяка. Характерной их особенностью является то, что в микродозах они необходимы для организма и в качестве микроэлементов принимают участие в важнейших физиологических процессах. С химической точки зрения многие «металлические» яды вступают во взаимодействие с пептидами, образуя комплексные соединения, и этим блокируют основные функции белка. В больших дозах они, прежде всего, блокируют ферментные системы, некоторые из них являются протоплазматическими ядами.
В организме человека «металлические» яды находятся в неионогенном состоянии, поэтому для их изолирования и дальнейшего определения необходимо перевести их в ионогеиное состояние. Обычно этот способ заключается в предварительной минерализации органической части объекта химико-токсикологического исследования, что также объединяет «металлические» яды в общую группу.
После разрушения биологического материала с помощью концентрированных серной и азотной кислот минерализат представляет собой бесцветную или слегка окрашенную в желтый цвет (за счет возможно иедоразрушеиных органических веществ) прозрачную жидкость. В присутствии соединений меди и хрома минерализат может быть окрашен в голубоватый или зеленоватый цвет. При наличии соединений свинца, бария, кальция минерализат, после разбавления его водой очищенной, содержит белый осадок, состоящий из сульфатов этих металлов. Для обнаружения «металлических» ядов в извлечениях из объектов используют атомно-абсорбционный и химические методы анализа.
10.1. Понятие об атомно-абсорбционной спектрометрии
Атомно-абсорбционная спектрометрия (ААС) предложена Уолшем в 1955 г. и предназначена для определения содержания химических элементов путем измерения абсорбции излучения атомными парами определяемого элемента. Физическую основу метода составляют следующие явления. При поглощении кванта света свободный атом переходит в возбужденное состояние А*.
A + hν → A*
где h — постоянная Планка, ν — частота, определяемая условиями перехода:
Наиболее вероятным изменением энергетического состояния атома при возбуждении является его переход на уровень, ближайший к основному энергетическому состоянию, т.е. резонансный переход.
Если иа невозбужденный атом направить излучение оптического диапазона с частотой, равной частоте резонансного перехода, кванты света будут поглощаться атомами. При этом наблюдается уменьшение интенсивности излучения, что фиксируется при определенной длине волны. В основе метода – регистрация спектров поглощения атомов, находящихся в газообразном состоянии в пламени при действии источника излучения. В таблице 54 приведены резонансные линии, предел определения элементов, смесь, образующая пламя-атомизатор.
Таблица 54. Обнаружение металлических ядов с помощью атомно-абсорбционной спектрометрии
| Элемент | Длина волны, нм | Чувствительность, мкг/мл | Состав пламени |
| Ag | 328,1 | 0,1 | ацетилен-воздух |
| As | 193,7 | 2 | ацетилен-воздух |
| Ва | 553,6 | 0.4 | ацетилен-кислород |
| Bi | 223,1 | 0,8 | ацетилен-воздух |
| Са | 422,7 | 0,1 | ацетилен-воздух |
| Cd | 228,8 | 0,03 | ацетилен-воздух |
| Со | 240,7 | 0,2 | ацетилен-воздух |
| Сг | 357,9 | 0,15 | ацетилен-воздух |
| Си | 324,7 | 0,15 | ацетилен-воздух |
| Fe | 248,3 | 0,15 | ацетилен-воздух |
| Hf | 307,3 | 15 | ацетилен-кислород |
| Hg | 253,7 | 15 | ацетилен-воздух |
| К | 766,5 | 0,1 | ацетилен-воздух |
| Mn | 279,5 | 0,1 | ацетилен-воздух |
| Mo | 313,3 | 0,4 | ацетилен-воздух, ацетилен-кислород |
| Na | 589,0 | 0,04 | ацетилен-воздух |
| Ni | 232,0 | 0,2 | ацетилен-воздух |
| Pb | 217,0 | 0,5 | ацетилен-воздух |
| Sb | 217,6 | 1 | ацетилен-воздух |
| Sn | 224.6 | 2 | водород-воздух |
| TI | 276,8 | 0,8 | ацетилен-воздух |
| V | 318,4 | 1,2 | ацетилен-кислород |
| Zn | 213,9 | 0,04 | ацетилен-кислород |
Принципиальная схема атомно-абсорбционного спектрометра представлена на рисунке 82.
Способ введения образца зависит от типа используемого генератора. Если генератором атомных паров является пламя, то в качестве растворителя для приготовления растворов образца и стандарта используют воду. Могут применяться органические растворители, если они не влияют на стабильность пламени.
Источник излучения – мощная лампа с полым катодом, которая испускает излучение с частотой, необходимой для регистрации определяемых элементов.
Монохроматор – призма, которая служит для выделения участка спектра с определенной длиной волны.
Наиболее часто используется пламя смеси ацетилена с воздухом (максимальная температура 2000°С), ацетилена с N20, температура – 2700°С, ацетилен с кислородом, водород с воздухом. Горелка со щелевидным соплом длиной 50-100 мм и шириной 0,5-0,8 мм устанавливается вдоль оптической оси прибора для увеличения длины поглощающего слоя и перевода исследуемой пробы в газообразное состояние. Раствор пробы вводят в пламя путем распыления с помощью пневматических распылителей. Через слой атомных паров пробы пропускают мощное излучение в диапазоне 190-850 нм. Метод основан на определении поглощения света атомами исследуемого образца.
Уменьшение интенсивности излучения подчиняется закону Бугера-Ламберта-Бера.
lg Io/I = A= klc
где Io u I — интенсивность излучения от источника соответственно до (Io) и после прохождения через поглощающий слой (I); А – оптическая плотность; к – коэффициент поглощения; I – толщина светопоглощающего слоя (пламени); с – концентрация анализируемого вещества.
Постоянство толщины светопоглощающего слоя, т.е. пламени, достигается с помощью горелок специальной конструкции.
Количественное определение методом атомно-абсорбционной спектрометрии проводят по следующей методике. Атомно-абсорбционный спектрометр выводят на режим согласно инструкции завода-изготовителя и устанавливают нужную длину волны. В генератор атомных паров вводят холостой раствор и настраивают детектор на максимальное свето- пропускание. Затем в пламя вводят раствор сравнения определяемого элемента с наибольшей концентрацией и настраивают детектор так, чтобы получить аналитический сигнал в оптимальном диапазоне измерений, после чего проводят анализ исследуемой пробы.
Расчет концентрации проводят по градуировочному графику или по методу добавок.
В химико-токсикологическом анализе метод атомно-абсорбционной спектроскопии предложен и используется для обнаружения и количественного определения «металлических» ядов. Метод изолирования – простое сжигание, мокрая минерализация с помощью серной и азотной кислот или минерализация при повышенных давлении и температуре при воздействии микроволнового излучения (в специальных тефлоновых камерах-бомбах в присутствии реагента окислителя – азотной кислоты) или в автоклавах при температуре 350°С.
Метод атомно-абсорбционной спектроскопии отличается простотой в выполнении, высокой селективностью, малым влиянием состава пробы на результаты анализа.
Этот метод применяют для определения
70 элементов (металлов). Он неприменим для неметаллов, резонансные линии которых лежат в вакуумной области спектра ( -2 – 1·10 -3 г/мл. По этой методике содержание свинца определяется в пределах 0,02-2 мг и более в 100 г исследуемого объекта.
Йодометрическое определение проводят после растворения сульфата свинца в ацетате аммония. К определенному объему раствора после нагревания его до кипения добавляют избыток 0,01 М раствора дихромата калия. Через 5 ч образовавшийся осадок хромата свинца отфильтровывают, фильтр промывают 2-3 раза 1% раствором уксусной кислоты до обесцвечивания его поверхности. К объединенному с промывными водами фильтрату добавляют 2 г йодида калия в 15-20 мл 5 М раствора серной кислоты. Емкость закрывают пробкой и оставляют в темном месте на 20 мин. Выделившийся йод оттитро- вывают тиосульфатом натрия (индикатор – крахмал).
Этим методом свинец определяется в 100 г объекта в количестве 2 мг и более.
Комплексонометрическое титрование. Определенный объем раствора осадка сульфата свинца в ацетате аммония помещают в колбу, добавляют избыток 0,01 М раствора комплексона III, 5 мл 3 М раствора аммиака, 100-150 мл воды очищенной, 10 мл аммиачно-хлоридного буфера, 0,1-0,2 г эриохрома ЕТ-00. Избыток комплексона III, не вступившего в реакцию со свинцом, титруют 0,01 М раствором сульфата цинка до перехода синей окраски индикатора в красно-фиолетовую. Метод позволяет определить в 100 г объекта 1-100 мг и более свинца.
10.5.2. Соединения бария
Свойства и токсикологическое значение. Барий – серебристо-белый ковкий металл. Барий применяется в качестве поглотителя газов в технике глубокого вакуума, в аппаратуре для получения серной кислоты и др.
Различные неорганические соединения бария находят применение в лабораторной практике, для изготовления запалов, в керамической, текстильной, кожевенной промышленности, в производстве минеральных красок, для производства оптического стекла и эмалей, в качестве протравы при крашении шерсти и ситца. В сельском хозяйстве хлорид бария используют для уничтожения вредителей растений, карбонат и селенит бария- в качестве дератизаторов,
В медицинской практике препараты бария находят применение при рентгенологических исследованиях. «Бария сульфат для рентгеноскопии» – белый тонкий рыхлый порошок без запаха и вкуса. Он нерастворим в воде, практически нерастворим в разведенных кислотах, щелочах, органических растворителях. Его применяют в виде суспензии в воде очищенной как контрастное средство при исследовании пищевода, желудка и кишечника. «Сульфобар» – это паста белого цвета, содержащая 50% сульфата бария, применяется в виде водной суспензии. Она хорошо обволакивает слизистую ЖКТ и обеспечивает высокое качество рентгеновского изображения. Медицинские препараты бария не должны содержать примеси растворимых его солей и карбоната бария, которые отличаются высокой токсичностью.
Барий поступает в организм на производствах и в плавильных цехах в виде пыли металла и его оксидов, которые частично вдыхаются, частично заглатываются. Откладывается барий в печени, мозге, железах внутренней секреции. Больше всего бария откладывается в костях (до 65%). Частично барий превращается в нерастворимый сульфат бария. Выделение бария происходит через ЖКТ и с мочой. Соединения бария вызывают заболевания головного мозга, спазм сосудов. При отравлении хлоридом бария повышается проницаемость капилляров, наблюдаются кровоизлияния и отеки. Смерть наступает от паралича сердечной деятельности.
При острой форме отравления появляется слюнотечение, ощущается жжение в полости рта, пищеводе. Позже возникают боли в желудке, тошнота, рвота, понос, цианоз слизистых оболочек, кожи лица, конечностей. При тяжелом отравлении смерть наступает в течение первых суток. Смертельная доза хлорида бария находится в пределах 0,8- 0,9 г.
Хроническая форма отравления проявляется при вдыхании солей, оксидов, пыли бария. Наблюдается раздражение верхних дыхательных путей, глаз, кожи, жидкий стул. Часто появляется слабость, головная боль, бессонница, отсутствие аппетита, нарушение сердечной проводимости, хронический бронхит, эмфизема, тремор пальцев рук, хрупкость ногтей.
Патологоморфологическая картина. При вскрытии погибших от отравления соединениями бария отмечают кровоизлияния в слизистой оболочке пищеварительного тракта, мозга, мозговых оболочек, некроз печени.
Обнаружение бария в минерализате проводят методом атомно-абсорбционной спектрометрии и с использованием химических реакций.
Атомно-абсорбционная спектрометрия. Обнаружение проводят по характерной для бария линии резонансного перехода при длине волны 553,6 нм.
Оценка метода. Предел обнаружения составляет 0,4 мкг бария в 1 мл исследуемой пробы.
Химический метод. Определение проводится дробным методом, разработанным А.Н.Крыловой.
Реакция перекристаллизации из концентрированной серной кислоты. Часть осадка с фильтра переносят на предметное стекло, добавляют 2 капли концентрированной серной кислоты и нагревают на пламени горелки до появления белых паров диоксида серы. По охлаждении под микроскопом наблюдают бесцветные кристаллы сульфата бария, имеющие форму прямоугольных пластинок, переходящих в кресты с перистыми разноплечными концами (рис. 85).
Оценка. Предел обнаружения составляет 0,05 мкг бария в исследуемой пробе.
Растворение сульфата бария через восстановительную реакцию. Часть осадка с фильтра нагревают на платиновой игле в восстановительной части пламени горелки.
Платиновую иглу время от времени погружают в 2 капли 10% раствора хлороводородной кислоты, находящейся на предметном стекле. При этом на платиновой игле происходит образование сульфида бария, который частично превращается в оксид бария.
При погружении платиновой иглы в раствор хлороводородной кислоты происходит растворение сульфида и оксида бария.
Затем на предметное стекло, содержащее раствор хлорида бария, помещают кристаллик йодата калия. Наблюдают образование характерного кристаллического осадка йодата бария.
Под микроскопом видны призматические кристаллы, собранные часто в сфероиды (рис. 86).
Оценка. Предел обнаружения по этой реакции – 0,03 мкг бария в исследуемой пробе.
Количественное определение
Количественное определение бария предложено проводить, используя атомноабсорбционную спектрометрию и гравиметрический метод.
Атомно-абсорбционная спектрометрия. Определение ведут по величине светопоглощения при длине волны 553,6 нм. Расчет концентрации проводят по градуировочному графику или с использованием метода добавок.
Гравиметрический метод. Барий после изолирования в минерализате находится в виде нерастворимого осадка сульфата бария.
Непосредственное определение бария по осадку в минерализате дает завышенные результаты до 144% за счет соосаждения ионов кальция и железа, которые естественно содержатся в органах человека в значительных количествах. Рекомендуется сульфат бария переосадить из аммиачного раствора трилона Б. Для этого весь осадок из минерализата растворяют в растворе трилона Б в присутствии аммиака при нагревании.
При этом образуются комплексные соединения трилона Б с ионами бария, железа и кальция. При дальнейшей нейтрализации раствора и добавлении сульфата аммония в осадок выпадает только сульфат бария, а соединения железа и кальция остаются в растворе.
Осадок сульфата бария отфильтровывают, высушивают до постоянной массы и взвешивают.
При содержании 10 мг бария в 100 г органа определяется данным методом в среднем 96% металла с относительной погрешностью 3,5%, при количестве 1 мг определяется 92% с относительной погрешностью 8,7%. По данным М.Д.Швайковой, достоверные результаты получают при содержании 5 и более мг бария в 100 г объекта.
Комплексонометрическое титрование. Осадок сульфата бария количественно переносят в стакан, добавляют определенный объем 0,01 М раствора комплексона III и 10 мл 8 М раствора аммиака. Смесь нагревают до кипения, охлаждают, добавляют 10 мл аммиачного буферного раствора, 0,2-0,3 г эриохрома черного ЕТ-00 и воды 100-150 мл. Избыток комплексона III оттитровывают 0,01 М раствором хлорида цинка до перехода синей окраски в красно-фиолетовую. Затем добавляют 3-5 мл избытка раствора хлорида цинка, 20-30 мл этилового спирта и оттитровывают избыток хлорида цинка 0,01 М раствором комплексона III до перехода красно-фиолетовой окраски в синюю. При расчетах учитывают сумму объемов комплексона III и хлорида цинка. 1 мл коплексона III соответствует 0,69 мг бария. Этим методом в 100 г объекта можно определить 0,5-10 мг бария.
10.5.3. Соединения марганца
По схеме исследования анализ минерализата начинают с обнаружения катионов марганца и хрома.
Свойства и токсикологическое значение. Марганец – серебристо-белый хрупкий металл, на воздухе покрывается пленкой оксидов. Марганец применяется в металлургии для обессеривания и раскисления плавки, при производстве чугуна повышенной прочности, твердых сталей, а также в сплавах с цветными металлами и для создания антикоррозийных защитных покрытий на металлах.
Неорганические соединения марганца применяются в качестве пигмента (марганцевый белый), для изготовления зеркального чугуна, термоиндикаторных покрытий, оксидных катализаторов, как компоненты микроудобрений, в производстве ферритов и красок, для окрашивания тканей, в текстильной, фарфоровой промышленности.
В медицинской практике применяют препарат «Калия перманганат». Это темно- или красно-фиолетовые кристаллы или мелкий порошок с металлическим блеском, растворим в воде, образует раствор темно-пурпурного цвета, является сильным окислителем. При смешивании с легко окисляющимися веществами может образовать взрывоопасную смесь. Применяют препарат как антисептическое средство наружно в водных растворах для промывания ран (0,1-0,5%), полоскания полости рта, горла, смазываний язвенных и ожоговых поверхностей, спринцеваний, промываний в гинекологической и урологической практике. Растворы (0,02-0,1%) применяют для промывания желудка при отравлениях морфином, никотином и другими алкалоидами, а также синильной кислотой (щелочные растворы). При отравлении кокаином, атропином, барбитуратами препарат неэффективен.
В организм соединения марганца попадают через ЖКТ (с пищей человек получает
4 мг марганца в сутки), через дыхательные пути в производственных условиях, через кожные покровы, например при купании детей в крепких растворах перманганата калия.
Особенно активно марганец и его соединения всасываются из легких. В крови марганец находится в виде белкового комплекса с γ-глобулинами. Накапливается марганец в печени, почках, в железах внутренней секреции, в мозгу. Выделение марганца с мочой незначительно. Преимущественно марганец выделяется через кишечник. Смертельная доза перманганата калия составляет 15-20 г.
Соединения марганца – это сильные протоплазматические яды, действующие на ЦНС, вызывая в ней тяжелые органические изменения. Большие дозы марганца угнетают рефлекторную возбудимость спинного мозга и ацетилхолинэстеразу. Как микроэлемент марганец принимает участие в окислительно-восстановительных процессах, в фосфорилировании.
Перманганат калия при соприкосновении с тканями образует оксид марганца (IV), гидроксид калия и атомарный кислород. Атомарный кислород и гидроксид калия являются основными поражающими агентами. Они вызывают химический ожог тканей и обусловливают болезненность при глотании, боли в подложечной области, рвоту с прожилками или даже со сгустками крови, кровавые поносы.
Острое отравление возникает при приеме крепких растворов перманганата калия внутрь, при полоскании, спринцевании. Появляется судорожная реакция, ожоговый шок, острая печеночно-почечная недостаточность в виде токсического гепатита, желтухи, анурии, уремии, у беременных – аборт за счет усиления сократительной деятельности матки. Острые отравления на производстве известны при вдыхании больших концентраций пыли оксидов марганца. Они характеризуются внезапным расстройством кровообращения, резкой одышкой, помрачением сознания.
При хроническом отравлении вначале наблюдаются функциональное поражение ЦНС и изменения со стороны желудка, затем к начальным симптомам добавляется токсическая энцефалопатия: движения рук теряют содружественность, появляется тремор пальцев, изменения в психической сфере. Характерно возникновение «марганцевого паркинсонизма», проявляющегося в маскообразности лица, вялости, безучастности, монотонной и затруднительной речи, «петушиной походке» (ходьба на носках и невозможность наступать на пятки).
Патологоанатомическая картина. При вскрытии наблюдают химический ожог слизистых и подслизистых оболочек ЖКТ и дыхательных путей, дистрофические изменения в печени, почках, сердце, ЦНС.
Обнаружение марганца в минерализате проводят с помощью атомноабсорбционной спектрометрии и с использованием химического метода.
Атомно-абсорбционная спектрометрия. Обнаружение проводят по характерной для марганца линии резонансного перехода при длине волны 279,5 нм.
Оценка метода. Предел обнаружения марганца составляет 0,1 мкг в 1 мл исследуемой пробы.
Химический метод. Для обнаружения марганца используется дробный метод анализа, разработанный А.Н.Крыловой. В минерализате марганец находится в виде солей низших валентностей. Для обнаружения их переводят в марганцовую кислоту путем окисления.
Реакция с перйодатом калия. В пробирку вносят 1 мл минерализата, 4 мл воды очищенной, 1 мл насыщенного раствора гидрофосфата натрия и 0,2 г перйодата калия. Пробирку нагревают на кипящей водяной бане в течение 20 мин – наблюдают окраску раствора в розовый или красно-фиолетовый цвет за счет образования марганцовой кислоты.
Реакция с персульфатом аммония. В пробирку вносят 1 мл минерализата, 4 мл воды очищенной, 1 мл насыщенного раствора гидрофосфата натрия. Смесь нагревают в течение 5-6 мин. К горячему раствору прибавляют 1 каплю 10% раствора нитрата серебра (катализатор) и 0,5 г персульфата аммония. Смесь нагревают в течение нескольких минут с целью разложения избытка добавленного персульфата аммония. Наблюдают появление в растворе розового или красно-фиолетового окрашивания.
Оценка. Предел обнаружения марганцовой кислоты составляет 1 • 10 -4 мг/мл. Реакции специфичны, так как другие ионы в указанных условиях не дают подобного окрашивания. Однако при реакции с перйодатом калия окраска получается более стабильной, при реакции с персульфатом аммония менее стабильна и устойчива при больших концентрациях марганцовой кислоты. Поэтому по первой реакции границей обнаружения марганца является его содержание 0,02 мг в 100 г объекта, а по второй реакции – 0,1 мг. Появление окрашивания только по первой реакции может указывать на обнаружение естественно содержащегося марганца. Появление окрашивания по двум реакциям является доказательством содержания в объекте марганца в количестве выше естественной нормы и требует проведения количественного определения.
Количественное определение
Определение количества марганца проводят методом атомно-абсорбционной спектрометрии и с помощью фотоколориметрического метода.
Атомно-абсорбционная спектрометрия. Определение ведут по величине светопо- глощения при длине волны 279,5 нм. Расчет концентрации марганца проводят по градуировочному графику или методом добавок.
Фотоколориметрический метод основан на окислении марганца (II) до марганца (VII). Оптическую плотность раствора измеряют при 525 нм в кювете с толщиной слоя 10 мм. Расчет концентрации марганца в минерализате ведут по калибровочному графику. Марганец может быть определен этим методом в количестве 0,02-20 мг и более в 100 г объекта.
10.5.4. Соединения хрома
Свойства и токсикологическое значение. Хром – голубовато-белый металл. Применяется в качестве легирующей добавки к сталям. Входит в состав некоторых огнеупоров, жаропрочных сплавов, для получения хромовых покрытий.
Различные оксиды хрома, хроматы, дихроматы, хромкалиевые и хромаммониевые квасцы, галогениды хрома входят в состав хромовых катализаторов, находят применение при изготовлении шлифовальных паст и красок для стекла и керамики, в производстве пигментов, как протрава при крашении, как окислители в органических синтезах, в металлообрабатываюшей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности, для дубления кож, при производстве кинопленок и др.
Металлический хром и его соединения низших степеней окисления малотоксичны, но в организме они могут переходить в соединения Cr (VI), которые имеют более высокую токсичность. В организм соединения хрома могут попадать через ЖКТ, ингаляционным путем и через кожные покровы.
Соединения Cr (VI) в организме частично восстанавливаются до Сr (III). Соединения хрома обладают наибольшим сродством к легочной ткани, но могут накапливаться также в печени, поджелудочной железе, костном мозге. Смертельная доза солей хромовой кислоты составляет 0,2-1 г. Выводятся соединения хрома с мочой, калом.
Соединения Cr (VI) оказывают раздражающее и прижигающее действие на слизистые оболочки и кожу, что приводит к изъязвлению, а при вдыхании аэрозолей – к поражению органов дыхания. Хроматы обладают канцерогенным действием. Общетоксическое действие проявляется в поражении печени, почек, желудочно-кишечного тракта, сердечнососудистой системы. Соединения Сr (III) изменяют активность ферментов, угнетают тканевое дыхание.
Острое отравление. При попадании соединений хрома через ЖКТ наблюдаются ожоги слизистой оболочки рта, пищевода, желудка, припухание, отечность, окрашивание в желтый цвет слизистой оболочки полости рта, рвота желтыми или зелеными массами, иногда кровавая.
При вдыхании аэрозоля хромовой кислоты поражаются дыхательные пути, наблюдается кашель с мокротой, затрудненное дыхание, повышение температуры тела, одышка, хрипы в легких. При остром отравлении хроматами и дихроматами наблюдается острая недостаточность почек с анурией, ацидозом, риниты, фарингиты, бронхиты.
Хроническое отравление. При длительном поступлении хрома и его соединений в организм человека возникает сухой кашель, бронхит, наблюдаются боли в эпигастральной области, изжога, тошнота, рвота, функциональные расстройства и признаки раздражения слизистой (гастрит и язвенная болезнь двенадцатиперстной кишки). При попадании на кожу проявляются дерматиты на кистях рук, предплечьях, на лице, на веках.
При вскрытии трупов отмечаются явления отравления едкими веществами и желтое окрашивание слизистых оболочек.
Обнаружение хрома в минерализате проводят с использованием атомноабсорбционной спектрометрии и характерных химических реакций.
Атомно-абсорбционная спектрометрия. Обнаружение проводят по характерной для хрома линии резонансного перехода при длине волны 357,9 нм.
Оценка метода. Предел обнаружения хрома составляет 0,15 мкг в 1 мл анализируемой пробы.
Химический метод. Для обнаружения хрома применяют дробный метод, разработанный А. Н. Крыловой. В минерализате хром находится в виде сульфата хрома (III) Cr2(SO4)3.
Реакция с дифенилкарбазидом (предварительная). К 1 мл минерализата прибавляют 4 мл воды очищенной, 1 каплю 10% раствора нитрата серебра и 0,5 г персульфата аммония. Содержимое пробирки нагревают на кипящей водяной бане в течение 20 минут. После охлаждения pH раствора доводят до 1,5-1,7 путем добавления 10% раствора натрия гидроксида. Затем добавляют 1 мл насыщенного раствора гидрофосфата натрия и вновь проверяют значение pH. При добавлении 1 мл 0,25% раствора дифенилкарбазида наблюдают образование розового или красно-фиолетового окрашивания.
Дифенилкарбазон, образовавшийся в процессе реакции, неокрашен. Затем происходит образование внутрикомплексной соли, имеющей розовую или красно-фиолетовую окраску.
Оценка. Реакция специфична, предел обнаружения составляет 0,2 мкг хрома в 1 мл минерализата.
Реакция образования пероксида хрома (подтверждающая). К 5 мл минерализата прибавляют 30% раствор гидроксида натрия до рН=7 (по универсальному индикатору), 1 каплю 10% раствора нитрата серебра, 0,5 г персульфата аммония и нагревают на кипящей водяной бане в течение 20 мин. После охлаждения до 10°С в бане со льдом к жидкости добавляют
1 мл насыщенного раствора гидрофосфата нагрия и вновь проверяют pH, затем прибавляют
2 мл этилового эфира и 2 капли 25% раствора пероксида водорода. Содержимое пробирки энергично взбалтывают. Наблюдают окрашивание эфирного слоя в голубой или синий цвет.
Оценка. Реакция специфична и наглядна для хрома, предел обнаружения составляет 2 мкг хрома в 1 мл минерализата.
Количественное определение
Количественное определение проводят с помощью атомно-абсорбционной спектрометрии и колориметрическим методом.
Атомно-абсорбционная спектрометрия. Определение ведут по величине светопоглощения при длине волны 357,9 нм. Расчет концентрации хрома проводят по градуировочному графику или методу добавок.
Фотоколориметрический метод основан иа получении окрашенного соединения с дифенилкарбазидом. Отмеряют 1 мл минерализата и проводят окисление хрома (III) в хром (VI) по методике, описанной в разделе «Обнаружение хрома». Затем к полученному раствору добавляют 1 мл насыщенного однозамещенного фосфата натрия и устанавливают рН=1,7 путем прибавления 10% раствора гидроксида натрия и добавляют 1 мл 0,25% раствора дифенилкарбазида в смеси спирта и ацетона (1:1). Оптическую плотность определяют при 546 нм в кювете с толщиной слоя 20 мм. Для расчета количества хрома в минерализате используют калибровочный график. Данным методом хром определяется в количестве 0,1-20 мг в 100 г объекта.
10.5.5. Соединения серебра
Свойства и токсикологическое значение. Серебро – белый блестящий металл, в тонких пленках в проходящем свете имеет голубой цвет.
Серебро применяется в виде сплавов для изготовления ювелирных и бытовых изделий, лабораторной посуды, для покрытия радиодеталей, в серебряно-цинковых аккумуляторах, в составе припоев, как катализатор в неорганическом и органическом синтезе. Из неорганических соединений серебра в промышленности находят применение нитрат серебра – AgNO, и другие соли. Эти соединения используются в фото- и кинопромышленности, для окраски специальных стекол, в производстве зеркал, для опреснения морской воды, для изготовления элементов оптики для ИК-спектрометров, твердых электролитов и датчиков, применяются как компоненты люминофоров, в органическом синтезе и в других областях.
Препараты серебра применяют в медицинской практике. «Серебра нитрат» – это бесцветные прозрачные крист аллы в виде пластинок или белых кристаллических палочек без запаха. Легко растворим в воде, растворим в спирте. Под действием света темнеет. «Протаргол» – коричнево-желтый или коричневый легкий порошок без запаха, слабогорького, вяжущего вкуса, легко растворим в воде, нерастворим в спирте, эфире, хлороформе. Содержит 7,8-8,3% серебра. «Колларгол» – зеленовато- или синевато-черные мелкие пластинки с металлическим блеском. Растворим в воде с образованием коллоидного раствора. Содержит 70% серебра. Препараты серебра применяют как вяжущие и противовоспалительные средства для смазывания слизистых оболочек, эрозий, язв, при избыточных грануляциях, трещинах, остром конъюнктивите, трахоме, хроническом ларингите. «Ляписный карандаш» – белая или серовато-белая твердая палочка конической формы с закругленной вершиной. Содержит нитраты серебра и калия. Применяется для прижиганий.
Серебро и его препараты попадают в организм через дыхательные пути на производствах и через желудочно-кишечный тракт.
В организме серебро легко проникает в эритроциты и связывается с белками. Крепкие растворы нитрата серебра образуют с тканями рыхлый альбуминат, денатурируют белки слизистых оболочек пищеварительного аппарата, образуя ожоги, что приводит к острым болям и шоковому состоянию. В организме соединения серебра могут восстанавливаться до металлического серебра, а серосодержащие соединения серебра частично переходят в сульфид серебра. Смертельная доза растворимых соединений серебра – около 2 г. Выделяются соединения серебра через кишечник.
Острое отравление. Характерными признаками отравления являются гастроэнтерит, боль в желудке и кишечнике. Слизистая оболочка рта белого или серого цвета. Рвотные массы – белые, темнеющие на свету. Наблюдаются понос, головокружение, судороги, параличи нижних конечностей, в тяжелых случаях – шоковое состояние с резким снижением артериального давления, расстройством дыхания, анурией, судорогами, коматозным состоянием.
Хроническое отравление. При многолетней работе с серебром и его солями серебро откладывается в соединительной ткани, стенках капилляров разных органов, в том числе в почках, костном мозге, селезенке, коже, слизистых оболочках и придает им серозеленую или аспидную окраску, особенно на открытых местах тела (аргирия). УФ-лучи усиливают пигментацию. Первые признаки аргирии появляются через 2—4 года от начала работы с соединениями серебра. Характерно, что у больных аргирией отсутствуют инфекционные заболевания за счет дезинфицирующего действия серебра. При аргирии появляются жалобы на боль в правом подреберье, увеличение печени, ослабление остроты зрения в сумерки. При попадании соединений серебра через дыхательные пути отмечено появление першения в горле, кашля, насморка с кровью, слезотечения.
Обнаружение серебра в минерализате проводят с помощью атомно-абсорбционной спектрометрии и химическим методом.
Атомно-абсорбционная спектрометрия. Обнаружение серебра проводится по характерной для серебра линии резонансного перехода при длине волны 328,1 нм.
Оценка метода. Предел обнаружения серебра составляет 0,1 мкг в 1 мл исследуемой пробы.
Химический метод. Используется дробный метод, разработанный А.Н.Крыловой. В минерализате серебро находится в виде сульфата серебра.
Реакция с дитизоном (предварительная). К 1 мл минерализата прибавляют 1 мл 8 М раствора серной кислоты и 3 мл 0,01% раствора дитизона в хлороформе. При встряхивании хлороформный слой приобретает золотисто-желтое окрашивание.
Ртуть с дитизоном также образует дитизонат оранжево-желтого цвета. Для отличия дитизоната серебра от дитизоната ртути окрашенный хлороформный слой отделяют и взбалтывают с 5 мл 0,5 М раствора хлороводородной кислоты. Дитизонат серебра разрушается, выделяется хлорид серебра, и золотистая окраска переходит в зеленую. Дитизонат ртути при взбалтывании с 0,5 М раствором хлороводородной кислоты не разрушается, и золотистая окраска слоя хлороформа не исчезает.
Оценка. Предел обнаружения по данной реакции 0,04 мкг серебра в 1 мл минерализата. Реакция имеет судебно-химическое значение при отрицательном результате.
Выделение серебра из минерализата. Проводится при получении положительного результата реакции образования дитизоната серебра. К 90 мл минерализата прибавляют 0,5 г хлорида натрия, нагревают и образовавшийся белый осадок хлорида серебра отфильтровывают. Осадок исследуют на соединения серебра проверочными реакциями, а фильтрат – на все остальные катионы.
Осадок растворяют в определенном объеме 25% раствора аммиака.
Полученный аммиачный раствор анализируют следующими реакциями.
Реакция с дихроматом калия. К нескольким каплям исследуемого раствора добавляют 10% раствор уксусной кислоты до кислой реакции и вносят небольшой кристалл дихромата или хромата калия. Наблюдают появление красного или красно-бурого окрашивания и кристаллического осадка (рис. 87).
Дихромат серебра образует кристаллы в виде прямоугольных и>ромбических пластинок оранжево-красного цвета. Предел обнаружения – 0,15 мкг серебра в исследуемой пробе.
Получение кристаллов аммиачного комплекса хчорида серебра. Полученный аммиачный раствор оставляют на предметном стекле. После удаления избытка аммиака под микроскопом наблюдают образование характерных мелких бесцветных кристаллов и сростки из тетраэдров и треугольников (рис. 88).
Оценка. Предел обнаружения составляет 0,05 мг серебра в исследуемой пробе.
Реакция с тиомочевиной и пикратом калия. Смешивают 2-3 капли полученного аммиачного раствора с насыщенными растворами тиомочевины и пикриновой кислоты. При наличии ионов серебра образуются кристаллы в виде желтых игл и розеток.
Оценка. Предел обнаружения составляет 0,03 мкг серебра в исследуемой пробе.
Реакция с хлоридом золота и хлоридом рубидия. 1- 2 капли аммиачного раствора осадка выпаривают досуха. На остаток наносят каплю раствора, содержащего хлориды рубидия и золота. Через 5-10 мин наблюдают образование гранатово-красных призматических кристаллов и сростков из них.
2АgСl · 3АuСl3 · 6RbCl
Оценка. Предел обнаружения составляет 0,1 мкг серебра в анализируемой пробе. Количественное определение
Для количественного определения серебра предложено несколько методов: атомно-абсорбционная спектрометрия, титриметрический и экстракционно-фотоколориметрический.
Атомно-абсорбционная спектрометрия. Определение количества серебра проводят по величине светопоглощения при длине волны 328,1 нм. Для расчета концентрации используют градуировочный график или метод добавок.
Титриметрический метод используется при положительных результатах качественных макрореакций с дитизоном и хлоридом натрия. В делительную воронку помещают 50 мл минерализата, добавляют 1 мл 0,01% раствора дитизона и 3 мл хлороформа. Смесь постоянно встряхивают и титруют 0,01 М раствором тиоцианата аммония до изменения золотисто-желтой окраски в зеленую. Определение серебра титриметрическим методом возможно при его содержании в 100 г органа в количестве 2-20 мг и более.
Экстакционно-фотоколориметрический метод. Используется при небольшом содержании серебра в минерализате (это визуально определяется по объему образующегося осадка AgCl при качественном обнаружении). В основе метода лежит реакция взаимодействия ионов серебра с дитизоном. Дитизонат серебра экстрагируют четыреххлористым углеродом. Оптическую плотность определяют при длине волны 426 нм в кювете с толщиной слоя 10 мм. Расчеты ведут по калибровочному графику. Метод позволяет определить в 100 г объекта 0,02-10 мг серебра.
http://xumuk.ru/toxicchem/136.html
http://farmf.ru/lekcii/gruppa-metallicheskih-yadov-drobnyj-himicheskij-metod-analiza/