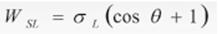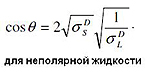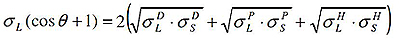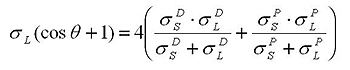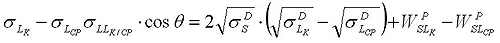Коллоидная химия. Шпаргалка
Данное издание создано в помощь студентам вузов, которые хотят быстро подготовиться к экзаменам и сдать сессию без проблем. Пособие составлено с учетом Государственного образовательного стандарта.
Оглавление
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
Свойства участка фазы, примыкающего к поверхности раздела фаз, отличаются от свойств фазы в объеме: частицы на поверхности каждой фазы образуют особую поверхностную фазу, свойства которой отличаются от свойств внутренних областей фазы. Частицы на поверхности находятся в другом окружении по сравнению с частицами, находящимися в объеме фазы, т. е. взаимодействуют как с однородными частицами, так и с частицами другого рода. Поэтому средняя энергия gs частицы на поверхности раздела фаз отличается от средней энергии такой же частицы в объеме фазы gv (причем энергия частицы на поверхности может быть как больше, так и меньше энергии частицы в объеме). Характеристикой поверхностной фазы является поверхностная энергия Gs — разность средней энергии частицы, находящейся на поверхности, и частицы, находящейся в объеме фазы, умноженная на число частиц на поверхности Ns:
Очевидно, что общая величина поверхностной энергии фазы будет определяться величиной ее поверхности S. Поэтому для характеристики поверхности раздела, отделяющей данную фазу от другой вводится понятие поверхностного натяжения δ — отношение поверхностной энергии к площади поверхности раздела фаз:
Как и поверхностная энергия фазы, поверхностное натяжение может иметь положительное или отрицательное значение. Оно положительно, если находящиеся на поверхности частицы взаимодействуют с частицами этой же фазы сильнее, чем с частицами другой фазы (и, следовательно, gs> gv). Согласно принципу минимума свободной энергии любая фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию, поэтому в случае положительного поверхностного натяжения (δ > 0) фаза стремится уменьшить свою поверхность. Если δ 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
Смотрите также
Философия. Конспекты + Шпаргалки. Две книги в одной!
Группа авторов, 2012
Гражданское право. Часть первая. Краткий курс
Коллектив авторов, 2016
Психология. Полный курс
Татьяна Петровна Ритерман, 2010
Статистика. Ответы на экзаменационные билеты
Ангелина Витальевна Яковлева, 2009
Ценные бумаги. Ответы на экзаменационные билеты
Надежда Новикова, 2009
Уголовный процесс. Шпаргалка
Михаил Белоусов, 2009
Бухгалтерское дело. Ответы на экзаменационные вопросы
О. В. Епифанов, 2009
Учебное пособие по органической химии. Часть 1. Алифатические соединения
Политология. Вопросы и ответы
А. А. Акмалова, 2008
Теория организации. Ответы на экзаменационные билеты
Сергей Викторович Загородников, 2009
Патентование изобретений в области высоких и нанотехнологий
Экономический анализ деятельности предприятия. Ответы на экзаменационные вопросы
С. С. Степанова, 2009
Ответы на экзаменационные вопросы по арбитражному процессуальному праву
Определение поверхностной энергии материала
Свободная поверхностная энергия (энегрия поверхностного слоя) твердых материалов не может быть измерена непосредственно, она рассчитывается на основе краевого угла смачивания поверхности различными жидкостями. Основная задача при анализе свободной энергии поверхности – правильно подобрать тестовые жидкости и метод расчета, чтобы получить максимально достоверные результаты.
Иногда встречается формулировка “поверхностная энергия эмульсий”, что не совсем корректно, поскольку эмульсия представляет собой систему “жидкость-жидкость”, а поверхностная энергия – это характеристика твердых тел. К эмульсиям правильно применять понятие “межфазное натяжение”.
Как правило, для неполярных поверхностей используют неполярные жидкости и теории, которые не придают особого значения межмолекулярным взаимодействиям. Для полярных поверхностей, наоборот, применяются полярные жидкости и теории, основанные на взаимодействии активных центров (молекул) поверхности с газовой или жидкой фазой. Специалисты фирмы KRUSS обнаружили, что для измерения СЭП в качестве жидкости хорошо подходят водные растворы спирта, т.к. полярность раствора меняется при изменении соотношения вода : спирт. Но смеси жидкостей следует использовать осторожно, т.к. смачивание поверхности одним компонентом смеси может быть выше.
Ниже описаны несколько теорий, используемых в расчете данных в приборах для измерения краевого угла KRUSS. Предпочтения выбора той или иной теории остается за пользователями. Обращаем Ваше внимание, что все эти методы расчета реализованы в программном обеспечении ADVANCE фирмы KRUSS. Программа ADVANCE имеет интуитивный интерфейс, что позволяет легко работать даже начинающим пользователям приборов для измерения краевого угла KRUSS.
Метод Зисмана
Зисман предполагал, что свободная энергия твердой поверхности пропорциональна поверхностному натяжению жидкости, полностью смачивающей эту поверхность (т.е. 




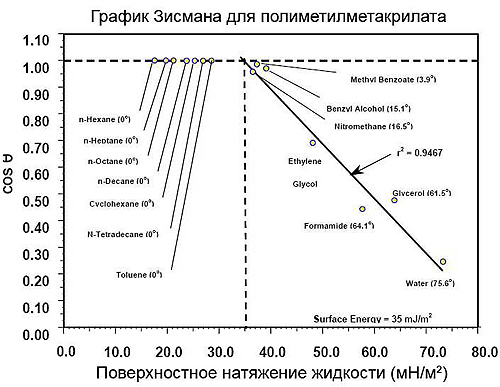
В основном теория Зисмана великолепно работает на неполярных поверхностях (полиэтилен, полипропилен). Но для полярных поверхностей (стекло, керамика и металлы) теория Зисмана неадекватна, т.к. она основана на однопараметрической модели. Полимерные поверхности, которые подвергались термообработке или обработке плазмой, как правило, будут содержать полярные центры. Кроме того, существуют полярные полимеры (с гетероатомами), например, полиамиды, полиэфиры, полиакрилаты, поликарбонаты и др. В этом методе игнорируются межмолекулярные взаимодействия между жидкостью и твердым телом, а они очень сильны для полярных веществ.
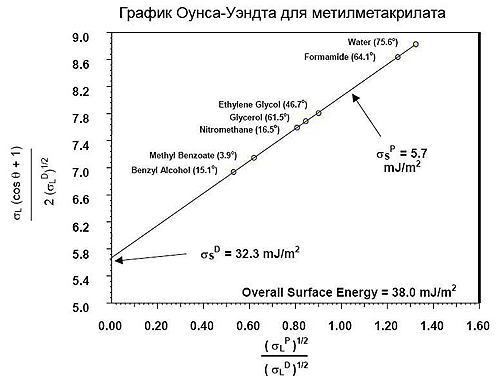
Метод ОВРК (метод Оунса, Вендта, Рабеля и Кьельбле)
Оунс, Вендт, Рабель и Кьельбле рассматривали поверхностное натяжение с точки зрения полярной и дисперсной составляющих. Они представили, что энергия поверхностного слоя твердого тела включает две составляющие: дисперсионную и полярную. Дисперсионная составляющая включает силы Ван-дер-Ваальса и другие неспецифические взаимодействия, полярная составляющая – сильные взаимодействия и водородные связи. На основе этих представлений было выведено уравнение.
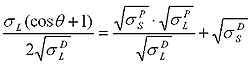
Для расчета по модели ОВРК кроме поверхностного натяжения жидкости и краевого угла, необходимо знать дисперсионную и полярную составляющие. Для определения полярной и дисперсионной составляющих жидкости используют поверхность с известными данными, например, тефлон (PTFE). Предполагается, что СЭП чистого тефлона 18.0 мДж/м2, и у него нет полярной составляющей. Значения полярной и дисперсионной составляющей для некоторых жидкостей имеются в литературе, а также в базе данных программ KRUSS. Зная составляющие жидкости, можно определить составляющие исследуемой твердой поверхности.
Двухкомпонентная модель Фоукса также рассматривает полярные и дисперсионные взаимодействия, но с точки зрения адгезии. С математической точки зрения, теория Фоукса равнозначна теории ОВРК, но данное уравнение решается в два этапа.
На первом этапе определяется дисперсная составляющая СЭП с помощью неполярной жидкости (как правило, дийодометана CH2I2): т.к. у такой жидкости нет полярной составляющей, то уравнение упрощается и дает возможность рассчитать дисперсионную составляющую СЭП твердой поверхности.
На втором этапе уравнение решают относительно полярной жидкости (как правило, воды), для которой известны полярная и дисперсионная составляющие.
Двухкомпонентная модель Фоукса подходит для полярных поверхностей, но этот подход дает более высокие значения СЭП, чем по методу ОВРК. Построенная на основе изучения адгезии, модель Фоукса часто используется для изучения адгезионных свойств покрытий. Многие пользователи определяют СЭП по методу Фоукса, затем по методу Оунса-Уэндта, и по разности этих значений находят энергию адгезии (энергию сцепления между поверхностью и покрытием). Наибольшая адгезия будет наблюдаться, когда поверхность с большим процентом полярной составляющей будет смачиваться столь же полярной жидкостью.
Метод Фоукса (расширенный)
В расширенном методе Фоукса, кроме полярной и дисперсной составляющих СЭП, рассматриваются водородные связи. В этом случае, решение уравнения проводится в три этапа: сначала с неполярной жидкостью, далее с полярной жидкостью, у которой отсутствуют водородные связи и завершается измерение на полярной жидкости с водородной составляющей.
При исследовании межфазного натяжения Ву также начал с полярной и дисперсной составляющих. Однако в отличие от других исследователей, которые использовали в своих расчетах геометрическую прогрессию, Ву взял за основу среднегармоническое значение. В результате он достиг более точных результатов, в частности для систем с большой свободной энергией поверхности.
Для решения уравнения Ву необходимо как минимум 2 жидкости: полярную и неполярную. Для увеличения точности расчета можно увеличить количество жидкостей. В результате решения уравнения получаются две пары решений. Если одно из них имеет отрицательные значения, то выбор сделать не трудно, в противном случае необходимо свериться с результатами по другим методам расчета.
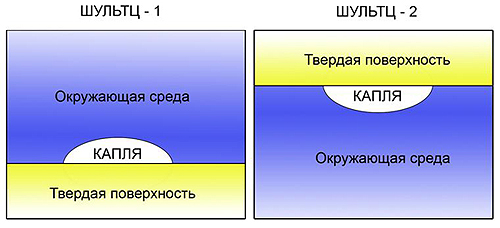
Данный метод используется только для поверхностей с высокой свободной энергией. Материалы с высокой энергией поверхности обычно хорошо смачиваются любыми жидкостями, поэтому их СЭП не может быть определена обычными методами. Для того чтобы исследовать такие системы, необходимо изменить обычную процедуру измерения: краевой угол («капли») измеряют в среде другой жидкости («среды») на или под поверхностью.
В методе Шультца-1 «капля» неизменна, а меняется окружающая фаза («среды«). В качестве «капли« обычно используется вода, в качестве окружающей среды – более легкая жидкость, которая не смешивается с водой.
В методе Шультца-2 «капля» – более легкая жидкость, чем окружающая среда. Капля находится под поверхностью и напоминает больше не «лежащую», а «висящую« каплю. В этом методе «среда« является постоянной жидкостью, а «капли» – различными. Преимуществом по отношению к методу Шультца-1 является то, что измеряемый краевой угол больше, а следовательно, выше точность.
Расчет СЭП производится аналогично расчету метода Фоукса. Сначала производится расчет по неполярной жидкости, обладающей только дисперсионной составляющей, что позволяет определить дисперсионную составляющую поверхности. Далее уравнение решается для полярной жидкости, чтобы определить полярную составляющую поверхности.
Метод Оусса и Гуда
Оусс и Гуд также выделяли дисперсионную и полярную составляющие свободной энергии поверхности, но полярный компонент описывали с помощью льюисовых кислот и оснований. Таким образом, у них получалась трехкомпонентная модель: дисперсионная, кислотная и щелочная составляющие. Кислотная составляющая характеризует склонность поверхности при участии во взаимодействиях выступать в качестве донора электронов, а щелочная составляющая – в качестве акцептора электронов.
Для того чтобы решить уравнение Оусса и Гуда (определить 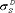

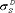
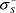
Свободная поверхностная энергия
Всякая поверхность раздела фаз сильно отличается по физико-химическим свойствам от обеих соприкасающихся фаз. Возьмем две соприкасающиеся фазы: газ и жидкость, рассмотрим поведение молекул жидкости внутри объема и на поверхности (рис. 9.3).
Между молекулами существует межмолекулярное взаимодействие. Если молекула находится внутри, она испытывает притяжение со стороны всех соседних молекул.
 |
Рис. 9.3. Действие межмолекулярных сил в объеме и на поверхности
Равнодействующая всех этих сил равна 0. Молекула, находящаяся на поверхности, испытывает притяжение только внутренних молекул (газ из-за своей разряженности взаимодействует слабо), равнодействующая этих сил направлена внутрь тела, т.е. явно выражено стремление к втягиванию поверхностных молекул внутрь тела, поверхность тела как бы находится в натянутом состоянии и стремится к своему сокращению. Поскольку действие сил на поверхностные молекулы не скомпенсировано, такие молекулы обладают свободной поверхностной энергией. Дадим определение.
Свободная поверхностная энергия – это избыток энергии молекул поверхностного слоя по сравнению с молекулами, находящимися внутри DE = E* – Eср.
Эта энергия зависит от природы вещества соприкасающихся фаз, от температуры и площади раздела фаз.
где Fs – свободная поверхностная энергия, Дж;
S – площадь раздела фаз, м 2 ;
s – коэффициент пропорциональности, называемый коэффициентом поверхностного натяжения (или просто поверхностное натяжение), Дж/м 2 .
Как известно, любая система стремится к минимуму энергии. Чтобы уменьшить свободную поверхностную энергию (Fs = sS) у системы есть два пути: уменьшить поверхностное натяжение s или
площадь поверхности раздела фаз S .
Уменьшение s происходит при адсорбции веществ на твердых и жидких поверхностях (это является движущей силой адсорбции), при растекании одной жидкости по другой.
Стремление к уменьшению площади поверхности S приводит к слиянию частиц дисперсной фазы, к их укрупнению (при этом удельная поверхность сокращается), т.е. в этом кроется причина термодинамической неустойчивости дисперсных систем.
Стремление жидкости к уменьшению поверхности приводит к тому, что она стремится принять форму шара. Математические расчеты показывают, что наименьшую площадь при постоянном объеме имеет шар, поэтому частицы жидкости принимают шарообразную форму, если только эти капли не расплющиваются под действием силы тяжести. Капли ртути на поверхности приобретают форму шариков. Сферическую форму планет также приписывают действию поверхностных сил.
Поверхностное натяжение
Физический смысл коэффициента поверхностного натяжения (s) можно истолковать с разных точек зрения.
1.Свободная поверхностная энергия (удельная поверхностная энергия)
Из выражения 9.3. следует

где Fs – свободная поверхностная энергия, Дж;
S – площадь поверхности раздела фаз, м 2 .
Отсюда следует физический смысл s – это свободная поверхностная энергия молекул поверхностного слоя на площади 1 м 2 (или на другой единичной площади), т.е. удельная поверхностная энергия.
Чем больше коэффициент s, тем больше величина поверхностной энергии (см. табл. 9.1.).
2. Работа по созданию новой поверхности
Поскольку энергия – это мера работоспособности, то, заменяя Fs на W, получаем:
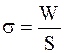
где W – работа по созданию новой поверхности раздела фаз, Дж;
S – площадь поверхности раздела фаз, м 2 .
Из выражения 9.5 следует, что s – это работа, которую надо совершить, чтобы в изотермических условиях увеличить на единицу площадь поверхности раздела фаз при неизменном объеме жидкости (т.е. перенести соответствующее число молекул жидкости из объема в поверхностный слой).
Например, при разбрызгивании жидкости совершается работа, которая переходит в свободную поверхностную энергию (при разбрыз-гивании поверхность раздела фаз многократно увеличивается). Такая же работа затрачивается при дроблении твердых тел.
Так как поверхностное натяжение связано с работой, расходуемой на разрыв межмолекулярных связей при переводе молекул из объема в поверхностный слой, то очевидно, что поверхностное натяжение является мерилом сил межмолекулярного взаимодействия внутри жидкости. Чем полярнее жидкость, тем сильнее взаимодействие между молекулами, тем сильнее поверхностные молекулы втягиваются внутрь, тем выше значение s.
Из жидкостей наибольшее значение s у воды (см. табл. 9.1.). Это неслучайно, поскольку между молекулами воды образуются достаточно прочные водородные связи. В неполярных углеводородах между молекулами существуют только слабые дисперсионные взаимодействия, поэтому поверхностное натяжение у них небольшое. Еще больше значение s у жидкой ртути. Это свидетельствует о значительном межатомном взаимодействии (и о большой величине свободной поверхностной энергии).
Высоким значением s характеризуются твердые тела.
Поверхностная сила
Есть также силовое толкование поверхностного натяжения. Исходя из размерности коэффициента поверхностного натяжения Дж/м 2 , можно записать
Таким образом, поверхностное натяжение – это поверхностная сила, приложенная к единице длины контура, ограничивающего поверхность и направленная на сокращение поверхности раздела фаз.
Существование этой силы наглядно иллюстрируется опытом Дюпре. На жесткой проволочной рамке закреплена подвижная перемычка (рис. 9.2). В рамке натянута мыльная пленка (положение 1). Чтобы растянуть эту пленку до положения 2, надо приложить силу F1, которой противодействует сила поверхностного натяжения F2. Эта сила направлена вдоль поверхности (по касательной), перпендикулярно к контуру, ограничивающему поверхность. Для пленки на рис. 9.2 роль части контура играет подвижная перемычка.
 |
Рис. 9.2. Опыт Дюпре

где F – сила, стягивающая контур поверхности, Н;
l – длина контура, м.
Действие поверхностного натяжения можно наглядно представить в виде совокупности сил, стягивающих края поверхности к центру (поэтому эта сила называется поверхностным натяжением). Эти силы изображены на рис. 9.3 стрелками – векторами; длина стрелок отражает величину поверхностного натяжения, а расстояние между ними соответствует единице длины контура.
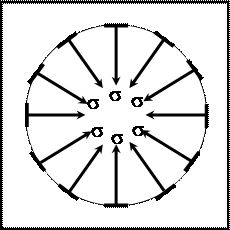 |
Рис. 9.3. Действие сил поверхностного натяжения
Таким образом, силы поверхностного натяжения обладают следующими свойствами:
1) равномерно распределены по линии раздела фаз;
2) направлены по касательной к поверхности;
3) направлены перпендикулярно линии раздела фаз;
4) направлены в сторону сокращения поверхности.
Поверхностное натяжение возникает на всех поверхностях раздела фаз. В соответствии с агрегатным состоянием этих фаз введены следующие обозначения:
sЖ-Г (на границе жидкость – газ)
sЖ1-Ж2(на границе двух несмешивающихся жидкостей)
sТ-Г (на границе твердое тело – газ)
sТ-Ж (на границе твердое тело – жидкость)
Значения коэффициентов поверхностного натяжения некоторых веществ на границе с воздухом и на некоторых межжидкостных границах приведены в табл. 9.3.
Непосредственно экспериментально можно определить поверхност-ное натяжение на границе жидкость – газ и жидкость – жидкость. Методы определения поверхностного натяжения на границе с твердым телом основаны на косвенных измерениях.
Методы определения поверхностного натяжения делятся на три группы: статические, полустатические и динамические.
Статическими методами определяется поверхностное натяжение практически неподвижных поверхностей, образованных задолго до начала измерений и поэтому находящихся в равновесии с объемом жидкости. К этим методам относятся метод капиллярного поднятия и метод лежащей или висящей капли (пузырька).
Динамические методы основаны на том, что некоторые виды механических воздействий на жидкость сопровождаются периодическими растяжениями и сжатиями ее поверхности, на которые влияет поверхностное натяжение. Этими методами определяется неравновесное значение s. К динамическим методам относятся методы капиллярных волн и колеблющейся струи.
Полустатическими называются методы определения поверхностного натяжения границы раздела фаз, возникающей и периодически обновляемой в процессе измерения (метод максимального давления пузырька и сталагмометрический метод), а также методы отрыва кольца и втягивания пластины. Эти методы позволяют определить равновесное значение поверхностного натяжения, если измерения проводятся в таких условиях, что время в течение которого происходит формирование поверхности раздела, значительно больше времени установления равновесия в системе.
Поверхностное натяжение (удельная поверхностная энергия)
некоторых веществ на границе с воздухом (298 К)
| Вещество | s, мДж/м 2 | Вещество | s, мДж/м 2 |
| Жидкость | Твердые тела | ||
| Гексан | 18,4 | Лед (270 К) | |
| Октан | 21,8 | Кварц | |
| Этанол | 22,0 | MgO | |
| Бензин | 25,0 | Алюминий | |
| Бензол | 28,2 | Железо | |
| Уксусная кислота | 27,8 | Вольфрам | |
| Муравьиная кислота | 36,6 | Алмаз | |
| Анилин | 43,2 | Полимеры | |
| Вода | 71,95 | Политетрафторэтилен | 18,5 |
| Ртуть | 473,5 | Полиэтилон | 31,0 |
| Жидкость – жидкость | Полистирол | 33,0 | |
| Бензол – вода | 34,4 | Поливинилхлорид | 40,0 |
| Анилин – вода | 4,8 | Плексиглас | 38,0 |
| Хлороформ – вода | 33,8 | Эмаль К-2 | 31,7 |
Метод капиллярного поднятия
Поднятие жидкости в капилляре (если жидкость хорошо смачивает стенки капилляра) обуславливается поверхностным натяжением. Между поверхностным натяжением и высотой поднятия жидкости в капилляре (рис. 9.4) существует следующая зависимость

где s – поверхностное натяжение; h – высота поднятия столба жидкости; r2 и r1 – плотности жидкости и насыщенного пара; g – ускорение свободного падения; q – краевой угол смачивания; r – радиус капилляра.
Для проведения эксперимента необходимы: капилляр диаметром 0,2-0,3 мм; сосуд, в который заливается исследуемая жидкость; катетометр для измерения высоты поднятия жидкости (точность ± 1 мкм) и устройство для подсветки мениска.
Наибольшие трудности вызывает измерение краевого угла смачивания q. Поэтому этот метод удобнее всего применять для жидкостей, у которых q = 0 0 .
 |
Рис. 9.4. Поднятие жидкости в капилляре
Это условие соблюдается для воды и многих органических жидкостей. Так как cos 0 0 = 1, то выражение (9.7) упрощается и может быть использовано для расчета s. Метод капиллярного поднятия – один из самых точных методов определения поверхностного натяжения.
http://tirit.org/articles/surface_theory_energy.php
http://lektsia.com/5x38b9.html