Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Справочный материал для подготовки к ОГЭ по химии
Химические свойства металлов и неметаллов
С чем реагируют металлы и неметаллы:
2Fe + 3Cl2 → 2FeCl3
2Fe + 3Cl2 → 2FeCl3
P + Cl2(изб) → PCl5
Только щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей:
Ca + 2H2O → Ca(OH)2 + H2 (комн. темп)
Mg + 2H2O → Mg(OH)2 + H2 (нагревание)
Только галогены реагируют с водой, но для ОГЭ этих реакций знать не нужно
Fe2O3 + 2Al → 2Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3
CO2 + Mg → MgO + C
SiO2 + 2Mg → 2MgO + Si
CuO + H2 → Cu + H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3H2 → 2Fe + 3H2O
В других случаях кислотные оксиды с неметаллами не реагируют.
Только с Al, Be и Zn:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Fe и Cr не реагируют с щелочами
Только P, S, галогены и Si реагируют с щелочами
(водород выделяется только в случае Si)
H2SO4 (конц). И HNO3 (любой концентрации)
Только с металлами до H2 в ряду напряжений металлов:
Fe + 2HCl → FeCl2 + H2
Реагируют со всеми металлами
Cu + 2H2SO4(к) → CuSO4 + SO2 + 2H2O
3Cu + 8HNO3(р) → 3Сu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3(к) → Сu(NO3)2 + 2NO2 + 2H2O
Концентрированные кислоты-окислители при tкомн. пассивируют Al, Cr, Fe, Ni.
Образование оксидов, кислот:
2H2SO4 (к) + C → CO2 + 2SO2 + 2H2O
4HNO3(р) + 3C → 3CO2 + 4NO + 2H2O
4HNO3(к, гор.) + C → CO2 + 4NO2 + 2H2O
Если металл (например, Fe) левее металла в составе соли (Cu) в ряду напряжений:
Металлы и неметаллы
Содержание:
Металлы — простые вещества, в которых атомы связаны металлической связью. Поэтому определяющие физические свойства чистых металлов (следствие наличия металлической связи).
Неметаллы – это все элементы (и простые вещества), не являющиеся металлами. В нашей периодической таблице символы неметаллов красные, а металлов – синие.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Металлы и неметаллы
Весь естественный мир состоит из химических элементов И даже далекие галактики состоят из тех же химических элементов что и наша Земля.
Наименьшая частица .любого химического элемента, обладающая всеми его свойствами. — это атом .
Химические элементы делятся на металлы и неметлллы
Все металлы (кроме ртути) твердые при нормальных условиях. Однако твердость их различна.
Некоторые неметллы в свободном виде при комнатной температуре являются газами, другие — твердые, и один — жидкий.
каждый из элементов периодической системы взаимосвязан с понятиями атом , простое или сложное вещество :
Металлы и неметаллы отличаются в первую очередь строением. Изобразим строение атома натрия и хлора
Сравните строение их внешних уровней. Легко заметить, что у металлов небольшое число электронов поэтому они легко отдают наружные электроны и проявляют восстановительные свойства. Склонность металла отдавать электроны зависит от его строения прежде всего, от размера атомов: чем больше атомные радиусы, тем легче металл отдает электроны.
Металлы — простые вещество . степень окисления атомов е них равна 0. Вступая в реакции, металлы почти всегда изменяют степень окисления своих атомов. Электроотрицательность этих атомов невелика. поэтому атомы металлов приобретают положительную степень окисления. Следовательно, все металлы в той или иной степени проявляют восстановительные свойства,
А неметаллы , наоборот, имеют большое число наружных электронов и легко присоединяют недостающие жмироны и проявляют окислительные свойства . Окислительная активность неметаллов зависит, с одной стороны, от размеров атомов (чем меньше атомы, тем активнее вещество), а с другой — от прочности ковалентных связей в простом веществе (чем прочнее связи, тем менее активно вещество).
В периодической системе свойства металлов и неметаллов изменяются в периодах и группах (рис. 36).
Наблюдаются раличия и в радиусах атомов этих элементов (рис. 37),
Аналогично существует различие в образовании химической связи у металлов и неметаллов:
Существуют различия и в кристаллических решетках простых веществ. У металлов только металлическая кристаллическая решетка, а неметаллам характерны атомные и молекулярные кристаллические решетки:
Безусловно, различия в строении атомов, видах химических связей и кристаллическом строении приводят к различиям в физических свойствах металлов и неметаллов (табл. 14).
Используя полученные знания in курса химии, на практике сравните физические свойства меди и серы.
Химические элементы делятся на металлы и неметаллы. Металлы — твердые вещества <кроме ртути). Неметаллы находятся в различных агрегатных состояниях.
Строение металлов и неметаллов — главная отличительная характеристика. Металлы имеют металлическую кристаллическую решетку. А неметаллам присущи молекулярные и атомные кристаллические решетки. Металлы проявляют восстановительные. а неметаллы окислительные свойства.
Сравнение химических свойств ii способов получения металлов и неметаллов
Атомы металлов, не обладая склонностью принимать электроны, могут только их отдавать пли обобщать. Все металлы в тон или иной степени проявляют восстановительные свойства.
Казалось бы, что самым активным из металлов должен быть фракций. Однако самый из долгоживущих изотопов фракция имеет период полураспада 22.3 мин. Его равновесное содержание в земной коре только 340 г. Кроме него имеется еще один вид с периодом полураспада 3.0 млн. Его равновесное содержание в земной коре составляет лишь 0.5 г.
Вследствие этого из применяемых металлов все-таки самым активным считается цезий.
Его легкость отдачи своего наружного электрона нашла применение в фотоэлементах.
Сравнительная активность металлов определяется схим рядом активности (приводится в сокращении):
Расположение лития на первом месте в этом ряду объясняется легкостью образования гидратной оболочки в водных растворах кислот и солей.
Из расположения металлов в этом ряду видно, что самыми активными металлами являются металлы с одним внешним электроном, а самыми устойчивыми — плашка и золото. Химические свойства металлов (рис. 37).
1. С неметаллами (не со всеми ):
Наиболее активные металлы легко реагируют с галогенами и кислородом. а с азотом реагируют только литий, кальций и магний.
Реагируя с кислородом, большинство металлов образует оксиды, а наиболее активные —пероксиды 
2. С оксидами менее активных мешаное :
3. С растворами кислот
В этом случае возможность реакции легко определяется по ряду напряжении (реакция протекает, если металл в ряду напряжений стоит до водорода).
4. С растворами солей :

Для определения возможности протекания реакции здесь также используется ряд напряжений.
5. Краме того, наиболее активные металлы (щелочные и щелочно-земельные ) реагируют с водой :
Большинство металлов в промышленности получают восстанавливая их оксиды:
В лаборатории этого часто используют водород. Наиболее активные металлы как в промышленности, так и в лаборатории получают с помощью электролиза.
В лаборатории менее активные металлы могут быть восстановлены из растворов их солен более активными металлами.
Неметаллы. В отличие от металлов, неметаллы обладают склонностью присоединять электроны, т, е. могут проявлять окислительные свойства. Самый активный неметалл — фтор. Он бурно взаимодействует почти со всеми веществами и с большинством из них — с горением и со взрывом. Контакт фтора с водородом приводит: к воспламенению и взрыву даже при очень низких температурах 
Неметаллы могут окислять:
2. Другие неметаллы :
3. Многие сложные вещества :
Фтор — самый сильный окислитель. Ненамного уступают ему кислород и хлор (обратите внимание на их положение в системе элементов).
В значительно меньшей степени окислительные свойства проявляют бор. графит, алмаз, кремний и другие простые вещества, образованные элементами, примыкающими к границе между металлами и неметаллами. Атомы этих элементов менее склонны присоединять электроны. Именно эти вещества (особенно графит и водород) способны проявлять восстановительные свойства:
Неметаллы получают из природных соединении, например, путем электролиза пли сложных окислительно-восстановительных процессов.
Металлы проявляют в химических реакциях свойства восстановителем. а неметаллы — свойства окислителей.
Сравнительная активность металлов определяется электрохимическим рядом активности. Метаны и неметаллы взаимодействуют с простыми и сложными веществами. Все металлы — восстановители, при взаимодействии с другими веществами отдают свои элекроны и окисляются. Самые сальные восстановители — щелочные металлы, А неметаллы при взаимодействии с другими веществами присоединяют электроны и восстанавливаются. Самый сильный окислитель — фтор.
Соединения металлов и неметаллов
После того как мы сравнили строение п свойства простых веществ металлов и неметаллов, можно приступить к более полном классификации и сравнению свойств важнейших соединений металлов и неметаллов.
Общие формулы водородных соединений по группам периодической системы химических элементов приведены в таблице 15.
С металлами водород образует (за некоторым исключением) нелетучие соединения, которые являются твердыми веществами немолекулярного строения, поэтому их температуры плавления сравнительно высоки, Такие соединения называются гидридами .
С неметаллами водород образует летучие соединения молекулярного строения (например, фтороводород HF, сероводород 





С кислородом неметаллы образуют кислотные оксиды, В одних оксидах они проявляют максима льнуло степень окисления, равную номеру группы (например. 




Характеристики кислородных соединений неметаллов
1. Свойства высших оксидов в периодах слева направо постепенно изменяются от основных к кислотным
2. В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
Существует несколько оксидов, которые в обычных условиях не реагируют ни с кислотами, им со щелочами. Такие оксиды называются несолеобразующими . Это например, 
Кислородные соединения металлов представлены в таблице 16
Как видите. важнейшие классы химических веществ различаются по разным классификационным признакам. Но по какому бы признаку мы ни выделяли класс веществ. все вещества этого класса обладают общими химическими свойствами. Соединения металлов и неметаллов могут взаимодействовать между собой, так как их свойства противоположны.
Между всеми соединениями металлов и неметаллов существует генетическая связь, с которой вы уже знакомы (рис. 38).
С металлами водород образует нелетучие твердые соединения — гидриды . С неметаллами водород образует летучие соединения молекулярного строения. При обычных условиях это газы или летучие жидкости.
С кислородом неметаллы образуют кислотные оксиды, а металлы — основные оксиды. Соединения металлов и неметаллов могут взаимодействовать между собой, так как их свойства противоположны. Между всеми соединениями металлов и неметаллов существует генетическая связь.
Биологическая роль металлов и неметаллов в жизнедеятельности живых организмов
Хорошо известно, что организмы в своем составе содержат различные химические элементы. В то же время организм человека нуждается в регулярном поступлении элементов извне, т. е. в химически сбалансированной пище. так как недостаток или избыток любого из элементов отрицательно сказывается на здоровье человека.
По современным представлениям из 118 известных элементов незаменимыми являются 22. Углерод, водород, азот и кислород не входят в этот список — они слишком широко природе.
Для удобства остальные элементы подразделяют на две большие группы: макроэлементы. присутствующие в больших количествах и микроэлементы . присутствующие в следовых количествах.
Макроэлементами принято считать те химические элементы, содержание которых в организме более 0,005% массы тела . Содержание макроэлементов в организме достаточно постоянно, но даже сравнительно большие отклонения от нормы совместимы с жизнедеятельностью организма.
К этой группе относятся водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций, Оиэло 96% от массы тела человека приходится на водород (H), кислород (О), углерод (С), азот (N). Они поступают в организм преимущественно в связанном виде с пищей, водой, воздухом и участвуют в большинстве химических реакции, протекающих в организме. Кроме того, эти элементы входят в состав белков, жиров и углеводов (рис. 39). К. этой же группе химических элементов относятся кальций (Са). фосфор (Р). калий (К), натрий (Na),
хлор (Сl). магний (Mg) и сера (S). На их долю в сумме приходится около 4% от массы организма.
Их роль сводится к:
— участию в пластических процессах и построении тканей (например, Р и Са — основные структурные компоненты костей);
— поддержанию кислотно-щелочного равновесия и водно-солевого обмена;
— поддержанию солевого состава крови и участию в структуре формирующих ее элементов:
— участию в структуре и функции большинства ферментативных систем и процессов, протекающих в организме.
Микроэлементами называются частицы, содержащиеся в организме в очень малых количествах . Иx содержание не превышает 0,005% массы тела, а концентрация в тканях— не более 0.000001%.
В связи с этим их часто называют «следовыми» химическими элементами.
В организме каждого взрослого человека присутствует небольшое количество микроэлементов. Несмотря на их малое содержание, микроэлементы чрезвычайно важны.
В таблице 18 приведен список важнейших из них. Кроме того, исследования на животных показали, что в следовых количествах незаменимыми являются кобальт (Со) никель (Ni) мышьяк (As) и кадмий
Макроэлементы сконцентрированы. как правило, в соединительных тканях (мышцы, кости, кровь), входя в состав органических соединений. Они определяют пластический материал основных несущих тканей, а также обеспечивают поддержку основных свойств внутренней среды организма в целом (гомеостаз): значение pH. осмотическое давление, кислотно-щелочное равновесие, устойчивость коллоидных систем в организме.
Микроэлементы неравномерно распределены между тканями н часто обладают сродством к определенному типу тканей и органон. Так, цинк аккумулируется в поджелудочной железе, молибден — в почках, барии — в сетчатке плаза, стронций — в костях, йод — в щитовидной железе (рис. 40. табл. 18).
Знаешь ли ты?
Снижение содержания цинка в плазме крови — обязательное следствие инфаркта миокарда.
Уменьшение содержания лития в крови — показатель гипертонического заболевания.
То, что, например, мышьяк, общеизвестный ял. незаменим для жизни, может вас удивить. Но нет ничего необычного в том, что одни и те же вещества могут приносить и пользу, и вред — все зависит от дозы. Даже поваренная соль может стать ядовитой, если попадет в организм в стишком больших количествах. Пороговое содержание различных элементов для организма человека представлен о в таблице 19.
Наша пища должна быть сбалансирована по необходимым химическим элементам. Правильное питание — залог здоровья каждого человека,
Знаешь ли ты?
Суточное потребление йода жителями Японии в несколько раз выше (за счет продуктов моря), чем в Центральной Азми.
В Казахстане снижено потребление йода, но превышено потребление калия, натрия.
Жители Индии потребляют с гнилей в 3 раза больше магния, марганца. железа, в 2 раза больше мели и калия, чем жители Англии.
В то же время англичане потребляют с пищей в 2 раза больше хрома и кальция.
В Англии потребление с пищей алюминия — в 20 раз, лития — в 10 раз, молибдена — в 3 раз,з ниже, чем в США. а хрома — в б раз. калышя — в 3 раза выше, чем в Германии
В состав клеток живых организмов, в т. ч. и человека, входят органические и неорганические вещества.
Химические элементы и их соединения, необходимые для нормальной жизнедеятельности организма в сравнительно больших количествах. называются .но-кролеиеимлхш , а элементы, требующиеся организмам в крайне малых количествах, — микроэлементами Среди микроэлементов также есть как неметаллы, так и металлы. Как избыток, так и недостаток элементов оказывает отрицательное влияние на организм, а некоторые элементы могут оказывать даже токсичное влияние.
Реакции, происходящие каждый день
- Фотосинтез
- Анаэробное клеточное дыхание
- Аэробное дыхание
- Горение
- Ржавление
- Смешивание продуктов питания
- Пищеварение
- Кислотно-основное взаимодействие
- Использование мыла
- Использование батареек
Невидимые чернила:
Китайский император использовал для своих тайных надписей невидимые чернила из рисового отвара, который после высыхания не оставлял никаких видимых следов. Однако если такое письмо слегка смочить слабым спиртовым раствором йода, то появляются синие буквы. Рис содержит крахмал, а крахмал выдает себя полностью при наличии йода.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Свойства простых веществ — металлов и неметаллов
Теория к заданию 6 из ЕГЭ по химии
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
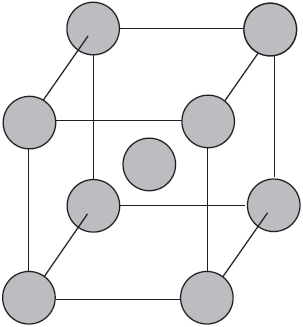
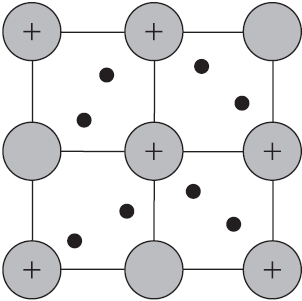
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^<2>2s^<2>2p^<6>3s^<1>3p^<0>3d^<0>$, где $3s, 3p, 3d$ — валентные орбитали.
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_ <пл.>железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_<пл.>=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
http://natalibrilenova.ru/metallyi-i-nemetallyi/
http://examer.ru/ege_po_himii/teoriya/svojstva_prostyx_veshhestv