2. Напишите уравнения реакций: а) горения метана в кислороде; б) дегидрирования этана; в) первой и второй стадий хлорирования метана; г) получения синтез-газа из метана.
2. Напишите уравнения реакций: а) горения метана в кислороде; б) дегидрирования этана; в) первой и второй стадий хлорирования метана; г) получения синтез-газа из метана.

задача №2
к главе «Тема II. Предельные углеводороды (алканы, или парафины). Работа 2 Изомерия, получение и химические свойства алканов. Вариант 4».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Расчеты горения
Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 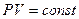
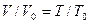
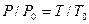
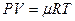
Рассмотрим реакцию горения водорода в кислороде: 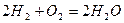
Рассмотрим реакцию горения метана в кислороде: 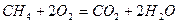
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м 3 кислорода содержится в 100/21 = 4,76 м 3 воздуха. Или на 1 м 3 кислорода приходится 3,76 м 3 азота. Отсюда условная формула воздуха: (О2 + 3,76N2).
Запишем реакцию горения водорода в воздухе:
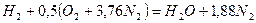
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м 3 водорода требуется 0,5 × 4,76 = 2,38 м 3 воздуха. Таким образом, для сгорания 1 м 3 водорода требуется 2,38 м 3 воздуха. В результате образуются продукты сгорания: 1 м 3 воды в виде пара и 1,88 м 3 азота.
Запишем реакцию горения метана в воздухе:
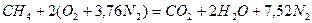
Из уравнения следует, что для полного сгорания 1 м 3 метана необходимо 2 × 4,76 = 9,52 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 метана требуется 9,52 м 3 сухого воздуха. Продукты сгорания содержат 1 м 3 диоксида углерода, 2 м 3 паров воды и 7,52 м 3 азота.
Запишем реакцию горения пропана в воздухе:
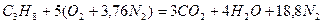
Из уравнения видно, что для полного сгорания 1 м 3 пропана необходимо 5 × 4,76 = 23,8 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 пропана требуется 23,8 м 3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α 1. Например, в процессе горения израсходовано 23 м 3 воздуха и 2 м 3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
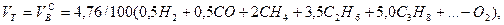
где 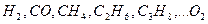
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
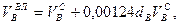
где 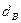
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
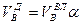
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 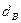

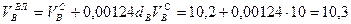
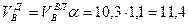
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
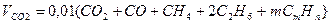
Объем водяных паров
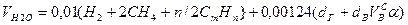
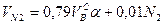
где N2 – процентное содержание азота в газовой смеси.
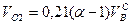
Суммарный объем продуктов сгорания

Дата добавления: 2015-06-22 ; просмотров: 8089 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Взаимодействие метана с кислородом. Реакция горения
Самый простой представитель алканов
Метан — это газообразное химическое соединение, химическая формула вещества — CH₄. Метан не имеет запаха, не имеет вкуса и является нетоксичным веществом. Предел воспламеняемости газа — его концентрация в воздухе от 5 до 15%.
Основные характеристики метана
Метан — самый простой представитель алканов. Эту группу органических соединений называют предельными, насыщенными или парафиновыми углеводородами. Они имеют простую связь между атомами углерода в молекуле, остальные валентности каждого углеродного атома насыщены атомами водорода. Самая важная реакция алканов — горение. Горят алканы с образованием паров воды и газообразной двуокиси углерода. В результате этой реакции в огромных количествах выделяется химическая энергия, которую можно преобразовать в электрическую или тепловую.
Горение метана используется для получения горячих дымовых газов, энергия которых обеспечивает работу газовой турбины. Во многих населенных пунктах метан подается по трубам в дома и используется для внутреннего отопления и приготовления пищи. Если сравнивать с другими видами углеводородного топлива, сжигание природного газа (метана) характеризуется меньшим выделением углекислого газа и большим количеством выделяемого тепла. Здесь вы найдете интересные эксперименты для изучения различных газов.
Метан с кислородом: реакция горения
Процесс горения метана — это взаимодействие метана с кислородом. В результате реакции образуется вода, двуокись углерода и много энергии. Уравнение реакции горения метана:
CH₄[газ] + 2O₂[газ] → CO₂[газ] + 2H₂O[пар] + 891кДж
Описание реакции
1 молекула метана при взаимодействии с 2 молекулами кислорода образует 1 молекулу двуокиси углерода и 2 молекулы воды. В процессе реакции выделяется тепловая энергия, равная 891 кДж.
Природный газ — самое чистое для сжигания ископаемое, имеющее простой состав и не выделяющее в воздух вредных химических веществ. Так как природный газ на 95% состоит из метана, то при его сжигании побочные продукты почти не образуются, или их образуется намного меньше, чем при использовании других видов ископаемого топлива.
Если внести в пламя метана фарфоровую крышку от тигля, она не закоптится, так как входящий в состав метана углерод сгорает полностью. Некоптящее пламя — это качественная реакция на предельные углеводороды.
http://helpiks.org/3-94961.html
http://melscience.com/RU-ru/articles/vzaimodejstvie-metana-s-kislorodom-reakciya-goreni/

