Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
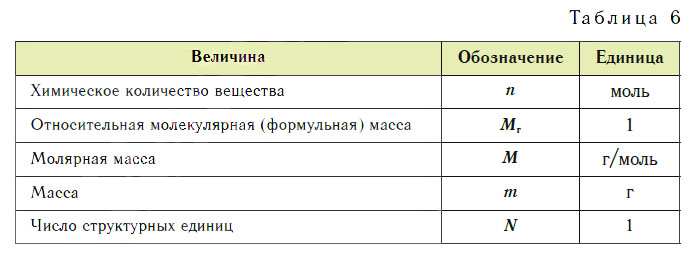
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Расчеты по химическим уравнением
Разделы: Химия
Чему бы ты ни учился, ты
учишься для себя.
Петроний
Цели урока:
- познакомить учащихся с основными способами решения задач по химическим уравнениям:
- находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ,
- продолжить формирование навыков работы с текстом задачи, умение аргументировано выбирать способ решения учебной задачи, умения составлять уравнения химических реакций.
- развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
- воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценить результаты своего труда.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
Ход и содержание урока
I Организационный момент.
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Слайд 1 (cм. презентацию).
Цели урока Слайд 2.
II.Актуализация знаний, умений, навыков.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы
Какое явление не является признаком химических превращений:
а) появление осадка; в) изменение объема;
а) уравнения реакций соединения
б) уравнения реакций замещения
в) уравнения реакций разложения Слайд 4
- Новая тема.
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
Запишем уравнение химической реакции:
Над формулой в уравнении реакции запишем найденное
значение количества вещества, а под формулами веществ —
стехиометрические соотношения, отображаемые
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
откуда х = 0,25 моль Слайд 7
Следовательно, n(O2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2) = 0,25 моль • 32 г/моль = 8 г
Ответ: m(О2) = 8 г Слайд 8
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
Vm=22,4л/моль Слайд 9
Запишем уравнение реакции. Расставим коэффициенты
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
Ответ: 5,6 л Слайд 11
III.Закрепление изученного материала.
Задачи для самостоятельного решения:
1.При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)? Слайд 12
Проверим решение задачи 1
M(Fe)=56г/моль,
m(Fe2O3)=
Проверим решение задачи 2
4.
х моль = 0,07моль,
m (H2O) = 
n(CuO) = 10г/ 80г/моль = 0,125 моль
х моль = 0,125моль, n(H2O)=0,125 моль
Ответ: 2,25г Слайд 15
Домашнее задание: изучить материал учебника с. 45-47, решить задачу
Какую массу оксида кальция и какой объм углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250г?
CaCO3 = CaO + CO Cлайд 16.
1. Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 8 — 9 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 8 класс.ВАКО, Москва, 2004г.
5. Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
6.Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000
Расчеты по химическим уравнениям
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Соотношение некоторых физико-химических величин и их единиц
Масса (m) : г ; кг ; мг
Кол-во в-ва (n) : моль ; кмоль ; ммоль
Молярная масса (M): г/моль ; кг/кмоль ; мг/ммоль
Объём (V) : л ; м 3 /кмоль; мл
Молярный объём(Vm) : л/моль ; м 3 /кмоль; мл/ммоль
Число частиц (N): 6•1023 (число Авагадро – NA); 6•1026 ; 6•1020
Практические работы по химии
материал
Практические работы по химии для специальностей СПО 1 курса
Скачать:
| Вложение | Размер |
|---|---|
| Расчёты по химическим формулам и уравнениям | 14.38 КБ |
| Распределение электронов в атомах | 13.05 КБ |
| Решение расчётных задач на определение объёмной и массовой доли компонентов смеси. | 15.08 КБ |
| Решение расчётных задач на массовую долю растворённого вещества. | 14.65 КБ |
| Решение задач по термохимическим уравнениям | 14.09 КБ |
| Классификация и изомерия органических соединений | 15.23 КБ |
| Решение расчётных задач на нахождение молекулярной формулы веществ по его плотности, массовой доле элемента. | 17.04 КБ |
| Решение расчётных задач на определение практического и теоретического выхода продукта | 16.63 КБ |
Предварительный просмотр:
ПРАКТИЧЕСКАЯ РАБОТА №1
Тема: Расчёты по химическим формулам и уравнениям
1.Цель работы: научиться делать расчёты по химическим формулам и уравнениям.
2.Оборудование: учебники, таблицы
3.Варианты заданий для практической работы:
1. При взаимодействии металлического натрия с водой выделилось 280 мл водорода. Сколько граммов натрия вступило в реакцию?
2.Какой объём этилена получится при дегидратации этилового спирта, масса которого 32,2 г.?
3.Найти массу аммиака, объём которого равен 33,6 м 3.
4.Сколько молекул содержится в 11 г. углекислого газа?
5.Найти массу 15*10 23 молекул кислорода.
6.Какое количество гидроксида калия потребуется для нейтрализации 0,3 моля сероводорода?
4.Пояснение к работе:
Формулы по химии
V=V m *n, где V m (молярный объем)=22,4 л
N=N A *n, где N A (Авогадро)=6*10 23 молекул/моль
4.Количество вещества (моль)
n=m/M; n= V / V m ; n= N / N A
По уравнению реакции 2Mg + O 2 = 2MgO
рассчитайте объем кислорода (н.у.), необходимого для полного сгорания 1,2 г магния.
n = 2моль n = 1моль
х = 1,2 х 22,4 / 48 = 0,56 л
Отчёт должен содержать:
6.Вывод по работе.
Предварительный просмотр:
Тема: Распределение электронов в атомах. Составление электронных формул атомов элементов и графических схем, заполнение их электронами.
1.Цель работы: Приобрести умения и навыки правильно распределять электроны по энергетическим уровням и изображать их графически.
2.Оборудование: учебники и таблицы.
3.Варианты заданий для практической работы:
1. Изобразите электронную конфигурацию атомов элементов:
В, N, F, Mg, Si, S, Cl
2.Дайте общую характеристику элементов по вариантам.
4.Пояснение к работе
Пример: элемент мышьяк(порядковый номер 33)находится в 4 периоде, в главной подгруппе V группы, его относительная масса-75. Ядро атома состоит из 33 протонов и 42 нейтронов. Электроны (их 33 ) расположены вокруг ядра на четырёх энергетических уровнях. Мышьяк р-элемент, его электронная формула1S 2 2S 2 2p 6 3S 2 3p 6 3d 10 4S 2 p 3 . Наличие пяти электронов на внешнем уровне атома мышьяка указывает на то, что мышьяк-неметалл. Однако он обладает слабо выраженными металлическими свойствами, поскольку в группе сверху вниз происходит ослабление неметаллических свойств. Высшая степень окисления V. Формула высшего оксида – As 2 O 5 .
4.Вывод к работе.
Предварительный просмотр:
Тема: Решение расчётных задач на определение объёмной и массовой доли компонентов смеси.
1. Цель работы: научиться решать расчётные задачи на определение объёмной и массовой доли компонентов смеси.
2. Оборудование: учебники, таблицы
3. Варианты заданий для практической работы:
1. В 380 мл воды растворили 20 г иодида калия. Определите массовую долю соли в полученном растворе.
2.Сколько потребуется соли и воды для приготовления раствора массой 180 г, с массовой долей растворённого вещества 20 %.
Пояснение к задаче: масса воды и соли в сумме дадут 180 г. Так как известна массовая доля, можно найти массу соли, а затем массу воды.
3.Какой объём кислорода может быть получен из 5 м 3 воздуха, если объемная доля кислорода в воздухе составляет 21%?
4.Газовая смесь состоит из фтора(F 2 ), хлора (Cl 2 ), аргона (Ar).Объёмная доля газа фтора 40%, объёмная доля газа хлора 20%. Определите массу аргона (Ar) в составе 11,2 литров смеси при нормальных условиях.
4. Пояснение к работе
ϕ вещества смеси (объёмная доля) =V одного в-ва / V смеси
1. Сколько граммов хлорида натрия потребуется для приготовления 250 г 10%-го раствора?
1.Определим массу вещества в растворе:
m в-ва = ω · m р-ра = 0,1 · 250 = 25 г хлорида натрия
2.Определяем массу воды, необходимой для приготовления раствора:
m H 2 O = m р-ра – m в-ва = 250 – 25 = 225 г
2. Вычислите объёмную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
V(N 2 ) =32 л 1.Найдём объём смеси газов:
V(CO 2 ) =32 л V(смеси) = V(N 2 ) + V(CO 2 ) +V(He)+ V(H 2 )= 32л +
V(He) =32 л 48л +36л +14л = 130 л
V(H 2 ) =32 л 2.Найдём объёмную долю азота в смеси:
Найти: ϕ вещества смеси =V ( N2 ) / V смеси = 32л/ 130л = 0,246, или 24,6%
ϕ (N 2 ) -? Ответ: ϕ (N 2 )= 0,246, или 24,6%
Отчёт должен содержать:
6.Вывод к работе.
Предварительный просмотр:
Тема: Решение расчётных задач на массовую долю растворённого вещества.
1. Цель работы: Приобрести умения и навыки решения задач на массовую долю растворённого вещества.
2. Оборудование: учебники, таблицы
3. Варианты заданий для практической работы:
1.В 150 г воды растворили 50г фосфорной кислоты. Найдите массовую долю кислоты в полученном растворе
2.Сколько грамм воды и нитрата натрия нужно взять, чтобы приготовить 80г 5-% раствора?
3.Найти массу азота, полученного из 280л воздуха, если известно, что объёмная доля азота в воздухе составляет 78%?
4.В растворе массой 100г содержится хлорид бария массой 20г.Какова массовая доля хлорида бария в растворе?
5.Сахар массой 5г растворили в воде массой 20г. Какова массовая доля (%) сахара в растворе?
4. Пояснение к работе
ϕ вещества смеси (объёмная доля) =V одного в-ва / V смеси
В 100 граммах воды растворили 25 граммов соли KCl. Определить массовую доли соли в полученном растворе.
ω (%)=m(вещества) / m (раствора) · 100%
ω (%)=m(KCl) / m (раствора) · 100%
m (раствора)= m((H 2 O) + m(KCl)= 100г + 25г =125г
ω (%)=m(KCl) / m (раствора) · 100%= ω (%)=25 г / 125г · 100%
Ответ: 20% раствора KCl
Отчёт должен содержать:
6.Вывод к работе.
Предварительный просмотр:
Тема: Решение задач по термохимическим уравнениям
1.Цель работы : Приобрести умения и навыки решения задач по термохимическим уравнениям.
2.Оборудование: учебники и таблицы
3.Варианты заданий для практической работы:
1.Согласно термохимическому уравнению реакции
СН 4 + 2О 2 = СО 2 + 2Н 2 О + 802 кДж
определите количество теплоты, выделившейся при сжигании 24 г метана.
2.Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
3.По термохимическому уравнению Н 2 + Cl 2 = 2 HCl + 184,36кДж рассчитайте, какой объём затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
4.Пояснение к работе
Определите количество теплоты, которое выделяется при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения: 2Mg + O 2 →2MgO + 1204 кДж
1)Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n( MgO ) = 120г / 40 г/моль = 3 моль
2) Составляем пропорцию с учётом коэффициентов в уравнении реакции
По уравнению 2 моля MgO – 1204 кДж
По условию 3 моля MgO – Q 1
Ответ: при образовании 120 г оксида магния выделится 1803 кДж энергии.
Отчёт должен содержать:
6.Вывод к работе.
Предварительный просмотр:
Тема: Классификация и изомерия органических соединений
1.Цель работы: Научиться составлять изомеры органических веществ.
2.Оборудование: учебники, таблицы.
3.Варианты заданий для практической работы:
Составьте изомеры следующих веществ:
С 6 Н 14 , С 5 Н 10 , С 6 Н 13 Сl, С 4 Н 9 ОН
Обусловлена, как правило, различиями в строении углеродного скелета, либо неодинаковым расположением функциональных групп или кратных связей.
Изомерия углеродного скелета
1)CH 3 – CH 2 –CH 2 –CH 2 – CH 3 н-пентан
2)CH 3 – CH –CH 2 – CH 3 2-метилбутан
CH 3 – CH –CH 3 2,2 –диметилпропан
Изомерия по положению бывает трёх видов:
- кратных связей – изомеры образуются благодаря перемещению кратных связей в молекуле: СН 2 =С=СН-СН 3 (бутадиен-1,2) и CH 2 =CH-CH=CH 2 (бутадиен-1,3);
- функциональной группы – изменение положения функционального радикала: СН 3 -СН 2 -СН 2 ОН (пропанол-1) и СН 3 — СНОН-СН 3 (пропанол-2);
- заместителя – присоединение радикала к другому атому углерода в молекуле: CH 3 -CHCl-CH 2 -CH 3 (2-хлорбутан) и CH 2 Cl-CH 2 -CH 2 -CH 3 (1-хлорбутан).
- Отчёт должен содержать:
- 1.Название работы.
- 2.Цель работы.
- 3.Задание.
- 4.Формулы изомеров веществ.
- 6.Вывод к работе.
Предварительный просмотр:
Тема: Решение расчётных задач на нахождение молекулярной формулы веществ по его плотности, массовой доле элемента.
1.Цель работы: расширить знания учащихся о способах решения задач;
закрепить навыки работы с алгоритмами; показать взаимосвязь химии и математики.
2.Оборудование: учебники, таблицы.
3.Варианты заданий для практической работы:
Задача 1. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода-14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 2. Найти молекулярную формулу предельного углеводорода,
массовая доля углерода в котором 83,3 %
Задача 3. При сжигании 29 г углеводорода образовалось 88 г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сгорании 11,2 г углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
4.Пояснение к работе
Задача. При сжигании 29 г углеводорода образовалось 88 г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
1.Записать условие задачи
D возд (C x H y )=2
молекулярную формулу C x H y
2.Найти относительную молекулярную массу вещества:
Мr = D возд · Мr(возд.)
Мr(C x H y )= 2·29=58
3.Найти количество вещества образовавшегося оксида углерода(IV):
n(CO 2 )= m(CO 2 )/M (CO 2 )
n(CO 2 )=88/44=2 моль
4.Найти количество вещества углерода в сожжённом веществе:
n(C) = n(CO 2 )= 2 моль
5.Найти количество вещества воды:
n(H 2 O) = 45/18 = 2,5 моль
6.Найти количество вещества водорода в сожжённом веществе:
n(H) = 2,5 · 2= 5 моль
7.Найти простейшую формулу углеводорода:
следовательно, простейшая формула – С 2 Н 5
8.Найти истинную формулу углеводорода:
Следовательно, истинная формула – С 4 Н 10 .
Задача. Найти молекулярную формулу вещества, содержащего 81,8 %
Углерода и 18,2 % водорода. Относительная плотность вещества по азоту равна 1,57.
1.Записать условие задачи.
D N2 (C x H y ) =1,57
молекулярную формулу C x H y
2.Вычислить относительную молекулярную массу Mr(C x H y ) по
Mr = D N2 · Mr(N 2 ),
Mr(C x H y ) =1,57 · 28= 43,96 = 44
3.Найти индексы х и у по отношению W(Э) / Ar(Э)
х:у = W(С) / Ar(С) : W(Н) / Ar(Н),
х:у = 0,818 / 12 : 0,182 / 1= 0,068 : 0,182 = 3:8
4.Записать простейшую формулу: С 3 Н 8 .
Проверка: Mr(С 3 Н 8 ) = 44, следовательно, С 3 Н 8 -истинная формула.
Отчёт должен содержать:
6.Вывод по работе.
Предварительный просмотр:
Тема: Решение расчётных задач на определение практического и теоретического выхода продукта
1.Цель работы: научиться решать задачи на определение практического и теоретического выхода продукта.
2.Оборудование: учебник, таблицы.
3.Варианты заданий для практической работы:
1.При взаимодействии натрия количеством вещества 0,5 моль с водой получили водород объёмом 4,2 л (н.у.). Вычислите практический выход газа (%).
2.Металлический хром получают восстановлением его оксида Cr 2 O 3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95%.
3.К раствору, содержащему хлорид кальция массой 45 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88%.
4.Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
4.Пояснение к работе
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
1. Записываем краткое условие задачи
m практическая (MgSO 4 ) = 5,5 г
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(MgSO 4 ) = 24 + 32 + 4 · 16 = 120 г/моль
4. Находим количество вещества реагента по формулам
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (m теор ) продукта реакции
m теор (MgSO 4 ) = M(MgSO 4 ) · ν теор (MgSO 4 ) =
= 120 г/моль · 0,05 моль = 6 г
6. Находим массовую (объёмную) долю выхода продукта по формуле
(MgSO 4 )=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
1. Записываем краткое условие задачи
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC 2 ) = 40 + 2 · 12 = 64г/моль
4. Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
6. Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC 2 ) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC 2 ) = 15,36 г
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
1. Записываем краткое условие задачи
V практич (CO 2 ) = 28,56 л
2. Находим по ПСХЭ молярные массы веществ, если это необходимо
M (Na 2 CO 3 ) =2·23 + 12 + 3·16 = 106 г/моль
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
= 28,56 л / 0,85 = 33,6 л
ν(CO 2 ) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Находим количество вещества реагента по УХР
ν(Na 2 CO 3 ) = ν(CO 2 ) = 1,5 моль
5. Определяем массу (объём) реагента по формуле:
V = ν · Vm m = ν · M m(Na 2 CO 3 ) = 106 г/моль · 1,5 моль = 159 г
Отчёт должен содержать:
6.Вывод к работе.
По теме: методические разработки, презентации и конспекты
СБОРНИК МЕТОДИЧЕСКИХ УКАЗАНИЙ ДЛЯ СТУДЕНТОВ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ ЗАНЯТИЙ И ЛАБОРАТОРНЫХ РАБОТ ДИСЦИПЛИНА «ХИМИЯ» общеобразовательного цикла технический профиль
Методические указания для выполнения практических занятий и лабораторных работ являются частью основной профессиональной образовательной программы государственного бюджетного образовательного уч.
Рабочая тетрадь для лабораторных и практических работ по дисциплине «Химия» 1 курс СПО
Рабочая тетрадь предназначена для работы студентов I курса по выполнению лабораторных и практических работ. Содержит контрольные задания и методику выполнения лабораторных и практических работы.
План-конспект практической работы по химии на тему «Скорость химических реакций»
Знание скоростей химических реакций имеет большое значение,как практическое так и научное.Например в химической промышленности от скорости химический реакции зависит качество продукта.Поэтому давайте .
3. 06 апреля 2020 г. Товары бытовой химии. Практическая работа №28. Практическая работа №29
Тема урока: Товары бытовой химии.Используя учебник товароведения, запишите в рабочую тетрадь классификацию, виды, отличительные особенности следующих товаров:1. Клеящие материалы;2. Синтетические моющ.
Методические рекомендации практических работ по химии
Методические рекомендации практических работ по химии.
Практические работы по химии
Практические работы по химии.
Методические рекомендации к выполнению практических работ по химии
Методические рекомендации к выполнению практических занятий по дисциплине «Химия» разработаны для студентов учреждений среднего профессионального образования. Практические занятия дополняю.
http://urok.1sept.ru/articles/612236
http://nsportal.ru/npo-spo/estestvennye-nauki/library/2020/03/31/prakticheskie-raboty-po-himii